Déterminer la concentration massique d'une solution aqueuse
Vue d'ensemble
Source : Laboratoire du Dr Neal Abrams — SUNY College of Environmental Science and Forestry
Détermination de la composition d’une solution est une technique analytique et médecine légale importante. Lorsque des solutions sont apportées avec de l’eau, ils sont dénommés est aqueuse, ou contenant de l’eau. La principale composante d’une solution est dénommée le solvant et la composante mineure dissoute est appelée le soluté. Le soluté est dissoute dans le solvant pour faire une solution. L’eau est le solvant plus courant dans la vie quotidienne, ainsi que presque tous les systèmes biologiques. Dans les laboratoires de chimie, le solvant peut être un autre liquide, tels que l’acétone, l’éther ou un alcool. Le soluté peut être un liquide ou un solide, mais cette expérience seule privéeLa détermination des solides.
Principles
Quand un soluté est dissout dans un solvant, la masse de la solution résultante est une somme de la masse du soluté et le solvant. Ceci fait suite à la Loi de Conservation de la masse :

Ceci diffère de l’ajout des volumes, qui est notadditive, puisque les molécules de soluté s’insérer dans les espaces libres entre les molécules du solvant et maintient le volume total plus faible que prévu. Déterminer le pourcentage en masse est une technique simple et importante pour analyser la composition de la solution. Par définition, un pour cent est une valeur sans unité fractionnaire d’un composant par rapport à l’ensemble. Dans ce cas, le pourcentage de la masse peut être représenté mathématiquement comme :
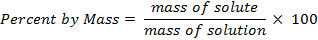
Bien que le pourcentage en masse est sans unité, cette valeur est parfois représentée avec les unités (w/w) pour transmettre que la comparaison est en masse (poids) seul et pas en volume. Pour cent par volume est indiquées en poids par volume (p/v) ou volume par volume (v/v). Dans les calculs de p/p, il est important de noter que le dénominateur est la masse de l’ensemble de la solution, pas du solvant. Alors que le pourcentage en masse est utilisée pour déterminer la concentration de la solution, pour cent par mole est généralement utilisée pour calculer le pourcentage d’anelement ou d’un groupe dans une molécule. Il est difficile de calculer le pourcentage de grain de beauté dans une solution, puisque les totales moles de soluté et le solvant auraient besoin d’être connu. Si ces valeurs étaient connus, le calcul du total ne serait pas pertinent.
Dans certains cas, obtenir la masse d’un solvant ou soluté individuellement peut être difficile ou impossible. Dans ces cas, la densité d’une solution peut être utilisée pour déterminer la masse pour cent en premier produisant une courbe d’étalonnage des solutions avec des compositions connues. Cela nécessite tout d’abord ce qui suit devant s’appeler : l’identité de la gamme raisonnable de soluté anda de concentration de la solution. Méthodes d’analyse plus complexes sont nécessaires lorsque plus d’un soluté est présente dans la solution. Par exemple, échange d’ions ou de précipitation sélective pourrait servir à analyser pour un soluté d’intérêt. Pour les solutions de soluté unique, assez de matériel doit être disponible pour créer une série de solutions de concentration connue. Deux pour cent par des méthodes de massives sont illustrés ici.
Procédure
1. le pourcentage en masse - Direct
- Placez un petit volume d’une solution dans un plat propre et séché au four bécher ou cristallisation.
- Après avoir déterminer avec précision la masse totale exacte de la solution, faire chauffer le bécher ou plat sur une plaque chauffante ou dans un four pour chasser l’eau. Évaporation lente est la meilleure méthode, comme ébullition peut entraîner des éclaboussures de la solution.
- Une fois que le solvant s’est évaporée, refroidir le reste solide (soluté) et déterminer la masse.
- Calculer le pourcentage massique comme :

2. le pourcentage en masse - à l’aide d’une courbe d’étalonnage
- Faire une série de solutions étalons en dissolvant les quantités connues de soluté dans un solvant. Cinq étalons sont recommandés et devraient s’échelonner entre le minimum et les compositions de pourcentage maximales prévues.
- Si on ne connaît pas la valeur approximative, produire une série de solutions allant de 0 % à travers le maximum de solubilité du soluté dans l’eau. Tableaux de référence sont disponibles pour indiquer la solubilité maximale pour les nombreux solides dans l’eau sur une variété de gammes de température.
- Par exemple, pour produire une solution de chlorure de sodium (NaCl) 35 % (p/p), ajoute 35 g dans une fiole, puis ajoute 65 g (ou 65 mL, en tant que volume peut également être utilisé lorsque l’eau pure de mesure depuis la densité est connu à 1,0 g/mL à une température ambiante) d’eau et mélanger la solution jusqu'à ce que le solide se dissout. Parce que la masse est additif, ce serait la même que l’ajout d’assez d’eau pour la solution totale a une masse de 100 g.
- Après avoir mesuré la masse d’un volume précis de chacune des solutions étalons, calculer la masse volumique comme :

3. analyse des données
- Tracer les valeurs de densité contre le pourcentage en masse des solutions étalons et déterminer la pente de la droite. Cette pente correspond à la densité vs pourcentage massique de la solution, ajustement d’une équation linéaire, y = mx + b (Figure 1).
- Calculer la masse volumique de la solution échantillon inconnu en obtenant la masse du volume spécifique de solutions. Maintenant que la pente de la droite est connue, déterminez le pourcentage en masse du soluté en résolvant pour « x » à l’aide de la masse volumique mesurée et la pente de la courbe d’étalonnage.
Résultats
À l’aide de l’exemple illustré dans la Figure 1, un ensemble de normes de chlorure de sodium a été préparé avec masse pourcentage compositions de 5,000 % 10,00 %, 15,00 %, 20.00 % et 25,00 % de soluté dans la solution. Les densités mesurées étaient de 1,025 1,042, 1.060, 1,070 et 1,090 g/mL, respectivement. Après traçage de ces données, une courbe de tendance linéaire est appliqué, montage de l’équation y = 3.446 x 10-3x + 1.0048, où y est la masse volumique et x est la composition en pourcentage de masse.
Ensuite, le volume de 10,00 g de solution avec composition pourcentage inconnue est mesuré et déterminé à 9,497 mL. En divisant la masse par le volume, la densité est alors calculée comme 1,053 g/mL. Insertion de la valeur de la densité dans l’équation linéaire, le pourcentage de masse est déterminé comme x:
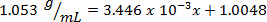


La figure 1. Densité de solution aqueuse de chlorure de sodium en fonction de la composition pour cent en masse.
Applications et Résumé
Le pourcentage de sucre dans la soude, pourrait facilement être determinedusing le principe de composition masse pour cent. La procédure pour faire cette expérience serait de mesurer la masse et le volume de soude dégazé (pas de bulles) et de calculer la densité de la solution. Une courbe d’étalonnage de la masse volumique vs % massique pour plusieurs solutionswould standard de saccharose (sucre) doivent être créées, et puis l’étalonnage pourrait servir à résoudre pour le pourcentage de saccharose dans la soude. Une hypothèse est que le saccharose est le principal contributeur à un changement de densité pour soda, ce qui est vrai pour soda sucre-non-libre.
L’eau de mer se compose de plusieurs différents sels dissous dans l’eau ; par exemple, NaCl, MgCl2et NaBr2. Alors qu’il serait difficile de déterminer le pourcentage de masse à l’aide d’une courbe d’étalonnage, évaporation fournit une solution simple au problème. En prenant une masse connue d’eau de mer et il d’évaporation, la masse peut être déterminée par la quantité de soluté restants, après que le solvant s’évapore. Ensuite, la masse du soluté doit être divisée par la masse totale de la solution originale pour calculer le pourcentage massique de sels (solides dissous) dans l’eau de mer.
Il existe une variété de composés ioniques qui sont des molécules d’eau et sont dénommés hydrates. Le nombre de molécules d’eau sur un composé peut être déterminé en composition pour cent. Par exemple, le chlorure de cobalt (II) est normalement bleu, mais devient rose quand il est hydraté. Si 5,0 grammes d’hydrate de chlorure de cobalt rose (II) est chauffée au point il vire au bleu, puis la messe finale du bleu solide est enregistrée comme 2,73. La différence, 2,27 g, correspond à la masse d’eau qui se trouvait sur la 5 g de solide hydraté. L’échantillon original a été eau de 45,4 % en masse. En convertissant les valeurs de masse mole, il peut être calculé que 0,02101 moles de chlorure de cobalt (129.93 g/mol) et 0,126 moles d’eau (18 g/mol) sont présents. En divisant par la plus petite valeur, il peut être déterminé que 6 moles d’eau sont présents pour chaque une mole de chlorure de cobalt.
Passer à...
Vidéos de cette collection:

Now Playing
Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.8K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
659.0K Vues

Solutions et Concentrations
General Chemistry
275.4K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
556.9K Vues

Déterminer la formule empirique
General Chemistry
183.8K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.6K Vues

Utiliser un pH-mètre
General Chemistry
346.9K Vues

Introduction au titrage
General Chemistry
425.7K Vues

Loi des gaz parfaits
General Chemistry
79.4K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.8K Vues

Principe de Le Châtelier
General Chemistry
265.8K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.8K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
196.4K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.8K Vues

Complexes de coordination
General Chemistry
91.8K Vues