Method Article
Analyse complète des plaquettes procoagulantes présentant des caractéristiques de nécrose, d’apoptose et d’activation plaquettaire
Dans cet article
Résumé
Le protocole actuel fournit un ensemble complet de procédures nécessaires à l’analyse des plaquettes procoagulantes, qui présentent des caractéristiques de nécrose, d’apoptose et d’activation plaquettaire qui se chevauchent.
Résumé
Les plaquettes circulant dans la circulation sanguine sont relativement calmes, mais deviennent « activées » lorsqu’elles rencontrent des stimulants ou des « agonistes » sur le site de la lésion des vaisseaux sanguins. Les plaquettes proagrégatrices et procoagulantes représentent deux populations distinctes de plaquettes activées. Alors que les plaquettes pro-agrégatrices facilitent l’arrêt des saignements, ou « hémostase », en formant un bouchon de plaquettes agglomérées par des ponts de fibrinogène, les plaquettes procoagulantes accélèrent considérablement la cascade de coagulation, aboutissant à la formation de caillots de fibrine. Un aspect intéressant des plaquettes procoagulantes est que leur morphologie présente certaines caractéristiques de « nécrose » et d'« apoptose ». Ils peuvent donc représenter une forme de mort cellulaire dans les plaquettes, bien qu’ils jouent un rôle important dans la thrombose et l’hémostase. Cet article présente le concept de plaquettes procoagulantes, leur pertinence pour la santé et la maladie, et une comparaison des méthodes existantes pour leur analyse. Il fournit ensuite des protocoles complets pour analyser les plaquettes procoagulantes, étudier les mécanismes de leur formation et évaluer leur rôle prothrombotique dans la facilitation de la coagulation. L’article se termine par une discussion sur les étapes clés, les limitations et les principes de dépannage des méthodes décrites.
Introduction
Il existe au moins deux populations distinctes de plaquettes activées 1,2. Les plaquettes pro-agrégatives sont caractérisées par une activation élevée de l’intégrine et une exposition faible, voire nulle, au PS. D’autre part, les plaquettes procoagulantes sont caractérisées par une faible activité de l’intégrine et une exposition élevée à la PS 1,2, fournissant une surface pour l’assemblage des complexes ténase et prothrombinase3, qui est 105-10 6 fois et 300000 fois plus active que les facteurs de phase solubles individuels IXa et Xa, respectivement4. Les plaquettes procoagulantes accélèrent ainsi considérablement la coagulation. Un aspect intéressant des plaquettes procoagulantes est que leur morphologie ressemble à certaines caractéristiques de la « nécrose » telles que la microvésiculation, le gonflement de la cellule avec perturbation cytosquelettique et la perte d’intégrité de la membrane, ainsi qu’à celles de l’apoptose telles que la perte de l’asymétrie des phospholipides membranaires avec l’exposition de la phosphatidylsérine dans le feuillet externe 5,6. En d’autres termes, la formation de plaquettes procoagulantes peut représenter une forme de mort cellulaire dans les plaquettes, bien qu’avec une fonction physiologique importante dans l’hémostase.
Les plaquettes procoagulantes sont significativement associées aux troubles thrombotiques. Alors que la plupart des individus en bonne santé n’ont pas de plaquettes procoagulantes circulantes, ~30 % des plaquettes de donneurs normaux adoptent un phénotype procoagulant ex vivo après une exposition à des agonistes puissants tels que la thrombine et le collagène7. Des plaquettes procoagulantes circulantes ont été rapportées dans les traumatismes, où leur formation peut refléter l’activation par l’histone H4 8,9. Dans la plupart des troubles prothrombotiques, cependant, des taux accrus de plaquettes procoagulantes ne sont détectés qu’après une stimulation ex vivo 10. Par exemple, les patients ayant subi un AVC aigu chez qui >51,1 % de leurs plaquettes ont été converties en plaquettes procoagulantes (également appelées plaquettes COATed) par le collagène et la thrombine présentaient un rapport de risque de 10,72 pour un AVC récurrent dans les 30 jours par rapport aux patients dont la formation de plaquettes procoagulantes était moindre11. Des résultats similaires ont été rapportés chez des patients atteints d’accidents ischémiques transitoires et d’athérosclérose carotidienne12. En revanche, le syndrome de Scott, un trouble de la coagulation, résulte d’une mutation de ANO6, qui code pour la phospholipide scramblase TMEM-16F, entraînant une exposition déficiente des plaquettes PS13. Les troubles hémorragiques idiopathiques et les hémorragies intracrâniennes peuvent être associés à une diminution de la capacité à générer des plaquettes procoagulantes14.
Par conséquent, l’évaluation des plaquettes procoagulantes fait partie de toute analyse de la fonction plaquettaire non seulement lors d’investigations de base sur les mécanismes d’activation plaquettaire et la thrombose et l’hémostase qui en résultent, mais également lors de l’analyse clinique du risque de thrombose ou d’hémorragie chez les patients au cours de divers états pathologiques. Un panel de l’International Society on Thrombosis and Haemostasis (ISTH) a recommandé l’utilisation de la liaison à l’annexine V et de l’expression de la P-sélectine par cytométrie en flux pour distinguer les procoagulants des autres sous-populations plaquettaires15. L’article traite également des différentes méthodes qui peuvent être utilisées pour analyser les plaquettes procoagulantes et apoptotiques, mais ne décrit pas les processus en détail. Ces méthodes comprennent la détection de (1) l’activation plaquettaire par PAC1/JonA ou la liaison au fibrinogène (cytométrie en flux) ; (2) sécrétion d’alpha-granules par expression de la P-sélectine (cytométrie en flux) ; (3) exposition au PS par liaison à l’annexine V/lactadhérine (cytométrie en flux) ; (4) perte d’intégrité membranaire par marquage GSAO (cytométrie en flux) ; (5) les changements morphologiques comme le ballonnement (microscopie) ; (6) détection de l’activation de la caspase par dosage de la caspase (immunoblotting/luminométrie/cytométrie en flux) ou de la dégradation du substrat du cytosquelette, la gelsoline (immunoblotting) ; (7) perte de potentiel de membrane mitochondriale par des colorants sensibles au potentiel mitochondrial tels que JC-1/Mitotracker (cytométrie en flux) ; (8) les marqueurs apoptotiques intrinsèques mitochondriaux Bax, Bak et la libération du cytochrome c (immunoblotting) ; (9) la fonction procoagulante par dosage de génération de thrombine et liaison du facteur de coagulation Xa/Va (cytométrie en flux, microscopie) ; (10) Augmentation du calcium cytosolique et mitochondrial par des colorants sensibles au calcium fluorescents (cytométrie en flux, fluorométrie, microscopie).
La présente étude se penche sur des protocoles complets pour l’analyse des plaquettes procoagulantes et les distingue des plaquettes proagrégantes et apoptotiques. La plupart des procédures décrites reposent sur la cytométrie en flux qui présente les avantages de (1) être facilement disponible et facile à utiliser, (2) nécessiter un faible volume d’échantillon et (3) permettre la détection simultanée de plusieurs sous-populations de plaquettes (proagrégatoire, procoagulante et apoptotique)15. Ces protocoles basés sur la cytométrie en flux sont complétés par des tests fonctionnels de l’activité procoagulante basés sur la liaison du facteur de coagulation et des tests de génération de thrombine basés sur le caillot.
Protocole
Les participants humains ont été recrutés dans l’étude pour un prélèvement de sang veineux périphérique après avoir obtenu un consentement éclairé écrit, en suivant strictement les recommandations et l’approbation du conseil d’examen institutionnel de l’Institut de recherche Lerner de la clinique de Cleveland, toutes les méthodologies de l’étude étant conformes aux normes établies par la Déclaration d’Helsinki. Les participants adultes en bonne santé de plus de 18 ans ont été inclus, tandis que ceux de moins de 18 ans, les personnes ayant des antécédents récents d’événements thrombotiques au cours des six derniers mois, ceux ayant des antécédents d’alcoolisme ou de toxicomanie et les participants ayant utilisé des médicaments antiplaquettaires ou anticoagulants au cours des quatre dernières semaines ont été exclus. Une description détaillée des matériaux et des réactifs utilisés dans les protocoles se trouve dans la Table des matériaux.
1. Préparation des plaquettes
- Prélever des échantillons de sang veineux périphérique dans l’anticoagulant ACD (1:9 v/v) chez les participants humains après avoir obtenu un consentement éclairé écrit, en suivant strictement les recommandations approuvées par le comité d’examen institutionnel.
- Centrifuger le sang prélevé dans l’ACD à 100 x g pendant 20 min à 22 °C pour obtenir du plasma riche en plaquettes (PRP) comme surnageant.
- Centrifuger le PRP à 800 x g pendant 7 min à 22 °C après ajout de 3 μM de PGE1 et 2 mM d’EDTA.
- Jetez le surnageant et remettez en suspension la pastille plaquettaire dans le tampon A (voir tableau des matériaux) par pipetage doux.
- Centrifuger les plaquettes remises en suspension dans le tampon A à 800 x g pendant 7 min à 22 °C.
- Remettre en suspension la pastille plaquettaire dans le tampon B (voir tableau des matériaux) par pipetage doux.
- Ajuster la numération plaquettaire finale à 1 × 107/mL à l’aide d’un compteur de cellules automatisé.
REMARQUE : Effectuez toutes les étapes dans des conditions stériles et prenez des précautions pour maintenir les plaquettes dans un état de repos en évitant l’exposition à un cisaillement excessif pendant le pipetage.
2. Analyse des plaquettes procoagulantes par cytométrie en flux
- Compléter les plaquettes humaines lavées avec 2,5 mM de calcium (0,5 μL de solution mère CaCl2 0,5 M dans 100 μL de suspension plaquettaire).
- Gardez une fraction des plaquettes non stimulée et stimulez les fractions restantes avec de la thrombine (0,1 U/mL, 0,25 U/mL, 0,5 U/mL), de la convulxine (20 ng/mL, 50 ng/mL, 100 ng/mL) ou leur combinaison pendant 15 min à température ambiante.
- Après la stimulation, ajoutez 1 μL d’anticorps PE-Annexine V, FITC-PAC1 et APC-anti-humain CD62P à 100 μL de suspensions plaquettaires stimulées.
- Incuber les plaquettes à l’obscurité à température ambiante pendant 30 min.
- Fixez les plaquettes en ajoutant un volume égal (1:1) de formol à 2 %.
- Analyser les échantillons par cytométrie en flux pour quantifier les plaquettes procoagulantes15,16.
- Dessinez une porte amorphe pour englober les plaquettes, en les séparant du bruit et des particules multiplaquettaires.
- Collectez toutes les données de fluorescence à l’aide de l’amplification logarithmique à quatre quadrants pour 10 000 événements dans la porte plaquettaire de chaque échantillon.
- Définir des régions pour les plaquettes en fonction de la positivité ou de la négativité de la fluorescence pour l’exposition à la phosphatidylsérine (PS) (liaison à l’annexine V), l’expression de la sélectine P (CD62P) et l’activation de l’intégrine αIIbβ3 (liaison PAC1).
- Considérons que les plaquettes sont positives pour l’exposition au PS (liaison à l’annexine V) et l’expression de la P-sélectine (CD62P), mais négatives pour l’activation de l’intégrine αIIbβ3 (liaison PAC1) en tant que plaquettes procoagulantes (Figure 1) (Tableau 1).
- De même, considérez les plaquettes positives pour l’activation de l’intégrine αIIbβ3 (liaison PAC1) et l’expression de la P-sélectine (CD62P), mais négatives pour l’exposition à la PS (liaison à l’annexine V) en tant que plaquettes proagrégatrices.
REMARQUE : Les plaquettes négatives pour l’activation de l’intégrine αIIbβ3 (liaison PAC1) et l’expression de la P-sélectine (CD62P) mais positives pour l’exposition au PS (liaison à l’annexine V) sont probablement des plaquettes apoptotiques15,16.
3. Analyse du calcium mitochondrial par cytométrie en flux
- Diluer les plaquettes humaines lavées à 1 × 106/mL et compléter avec 2,5 mM de calcium (0,5 μL de solution mère de CaCl2 0,5 M dans une suspension plaquettaire de 100 μL).
- Étiqueter les plaquettes avec 5 μM Rhod-2 AM (pour le calcium mitochondrial) pendant 30 min dans l’obscurité.
- Éliminez les plaquettes de manière appropriée, comme décrit à l’étape 2.
- Analysez les événements dans la porte plaquettaire pour les changements dépendants du temps de la fluorescence moyenne des événements acquis sur 5 min à l’aide d’un nuage de points de densité de la fluorescence PE (pour Rhod-2 AM) en fonction du temps.
- Enregistrez les taux de calcium de base pendant les 1 première minute.
- Ajoutez de la thrombine (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), des convulxines (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou leur combinaison, et continuez à recueillir des données pendant encore 4 min17.
4. Analyse du potentiel de la membrane mitochondriale par cytométrie en flux
- Compléter les plaquettes humaines lavées avec 2,5 mM de calcium (0,5 μL de solution mère CaCl2 0,5 M dans 100 μL de suspension plaquettaire).
- Gardez une fraction de plaquettes non stimulée et stimulez les fractions restantes avec de la thrombine (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), de la convulxine (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou leur combinaison pendant 15 min à température ambiante.
- Après la stimulation, ajouter un colorant de marquage des mitochondries (voir le tableau des matériaux) à une concentration finale de 500 nM aux suspensions plaquettaires stimulées.
- Incuber les plaquettes pendant 30 min dans l’obscurité.
- Fixez les plaquettes en ajoutant un volume égal de formol à 2 %.
- Analyse d’échantillons par cytométrie en flux17.
- Éliminez les plaquettes de manière appropriée comme décrit à l’étape 2.
- Analysez les événements dans la porte plaquettaire pour une baisse de fluorescence dans le canal PE (pour le colorant de marquage des mitochondries) du cytomètre en flux.
5. Analyse de l’activité de la caspase 3 et de la caspase 8 par cytométrie en flux
- Compléter les plaquettes humaines lavées avec 2,5 mM de calcium (0,5 μL de solution mère CaCl2 0,5 M dans 100 μL de suspension plaquettaire).
- Gardez une fraction de plaquettes non stimulée et stimulez les fractions restantes avec de la thrombine (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), de la convulxine (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou leur combinaison pendant 15 min à température ambiante.
- Après la stimulation, ajouter soit un réactif de détection de l’apoptose 1:1000 (v/v) (voir le tableau des matériaux) (pour les voies d’apoptose intrinsèque et extrinsèque), soit 1:300 (v/v) FITC-IETD-FMK (pour la caspase 8 de la voie d’apoptose extrinsèque) aux suspensions plaquettaires stimulées.
- Incuber les plaquettes pendant 30 min dans l’obscurité.
- Fixez les plaquettes en ajoutant un volume égal de formol à 2 %.
- Analyse d’échantillons par cytométrie en flux17.
- Éliminez les plaquettes de manière appropriée, comme décrit à l’étape 2.
- Analysez les événements dans la porte plaquettaire pour la fluorescence dans le canal FITC (pour la caspase 3/7 ou la caspase 8) du cytomètre en flux.
6. Analyse de la liaison de la prothrombine par cytométrie en flux
- Conjuguez la prothrombine bovine avec le colorant Alexa Fluor 488 à l’aide d’un kit d’étiquetage des protéines (voir le tableau des matériaux), en suivant les instructions du fabricant.
- Compléter les plaquettes humaines lavées avec 2,5 mM de calcium (0,5 μL de solution mère de CaCl2 0,5 M dans une suspension plaquettaire de 100 μL).
- Gardez une fraction de plaquettes non stimulée et stimulez les fractions restantes avec de la thrombine (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), de la convulxine (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou leur combinaison pendant 15 min à température ambiante.
- Après la stimulation, ajoutez de la prothrombine bovine conjuguée à l’AF488 (100 μg/mL) et 1 μL de PE-Annexine V et d’anticorps anti-CD62P humain APC à 100 μL de suspensions plaquettaires stimulées.
- Fixez les plaquettes en ajoutant un volume égal de formol à 2 %.
- Analyser des échantillons par cytométrie en flux17 pour la quantification de la liaison de la prothrombine aux plaquettes.
- Dessinez une porte amorphe pour englober les plaquettes séparément du bruit et les particules multiplaquettaires.
- Collectez toutes les données de fluorescence à l’aide de l’amplification logarithmique à quatre quadrants pour 10 000 événements dans la porte plaquettaire de chaque échantillon.
- Dessiner des régions pour les plaquettes avec une fluorescence positive ou négative pour l’exposition au PS (liaison à l’annexine V), l’expression de la P-sélectine (CD62P) et la prothrombine AF488 (liaison à la prothrombine).
- Déterminer la proportion de tous les événements plaquettaires, ainsi que la proportion de plaquettes positives pour l’exposition au PS (liaison à l’annexine V) et l’expression de la P-sélectine (CD62P) (plaquettes procoagulantes), qui sont positives pour la liaison à la prothrombine.
7. Analyse de la liaison de la prothrombine par microscopie confocale
- Conjuguez la prothrombine bovine avec le colorant Alexa Fluor 488 à l’aide d’un kit d’étiquetage des protéines (voir le tableau des matériaux), en suivant les instructions du fabricant.
- Compléter les plaquettes humaines lavées avec 2,5 mM de calcium (0,5 μL de solution mère de CaCl2 0,5 M dans une suspension plaquettaire de 100 μL).
- Gardez une fraction de plaquettes non stimulée et stimulez les fractions restantes avec de la thrombine (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), de la convulxine (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou leur combinaison pendant 15 min à température ambiante.
- Après la stimulation, ajoutez de la prothrombine bovine conjuguée à l’AF488 (100 μg/mL) et 1 μL de PE-Annexine V et d’anticorps anti-CD62P humain APC à 100 μL de suspensions plaquettaires stimulées.
- Fixez les plaquettes en ajoutant un volume égal de formol à 2 %.
- Granulez les plaquettes fixées sur des lamelles enrobées de poly-D-lysine.
- Montez les lamelles sur les lames de microscopie à l’aide d’une solution anti-décoloration.
- Vous pouvez également enduire les lamelles de collagène (100 μg/mL) pendant 1 h dans une chambre humide.
- Bloquer les lamelles enrobées avec 0,5 % de BSA dans du PBS pendant 1 h.
- Étiquetez les plaquettes avec de la prothrombine bovine conjuguée à l’AF488 (100 μg/mL) et 1 μL chacun d’anticorps PE-Annexine V et d’anticorps anti-CD62P humain APC.
- Laissez les plaquettes étiquetées adhérer pendant 20 minutes sur des lamelles enrobées de collagène.
- Lavez trois fois les lamelles avec des plaquettes adhérentes avec du PBS.
- Fixer les lamelles avec 2 % de paraformaldéhyde pendant 1 h.
- Montez les lamelles sur les lames de microscopie à l’aide d’une solution anti-décoloration.
- Observez les lames sous un microscope confocal à 63× grossissement de l’objectif.
- Analysez les images à l’aide d’un logiciel Fidji pour la quantification de la fluorescence.
8. Test de génération de thrombine dépendante des phospholipides plaquettaires à base de caillot
- Compléter les plaquettes humaines lavées avec 2,5 mM de calcium (0,5 μL de solution mère CaCl2 0,5 M dans 100 μL de suspension plaquettaire).
- Gardez une fraction de plaquettes non stimulée et stimulez les fractions restantes avec de la thrombine (0,1 U/mL, 0,25 U/mL ou 0,5 U/mL), de la convulxine (20 ng/mL, 50 ng/mL ou 100 ng/mL) ou leur combinaison pendant 15 min à température ambiante.
- Ajouter 100 μL de plaquettes traitées à un mélange de 50 μL de plasma normal mélangé et de 50 μL de solution de kaolin à faible turbidité (20 mg/mL), préincubé à 37 °C pendant 5 min.
- Ajouter 5 mM de CaCl2 au mélange.
- Surveiller la formation de caillots par turbidimétrie sur un lecteur de microplaques, en mesurant l’absorbance à 660 nm toutes les 60 s pendant 1 h.
Résultats
Une proportion de plaquettes activées devient « procoagulante » avec une augmentation caractéristique de l’expression de surface de la phosphatidylsérine (PS) et de la P-sélectine, ce qui les distingue des plaquettes « apoptotiques » qui ne sont positives que pour l’exposition à la PS ainsi que des plaquettes « proagrégatives » qui sont positives pour l’expression de la P-sélectine. Nous avons constaté que la thrombine induit une augmentation dose-dépendante de la proportion de plaquettes procoagulantes positives pour l’expression de la P-sélectine et de la PS, détectée par la liaison de l’anticorps FITC-anti-CD62P et de l’anticorps PE-Annexine V, respectivement (Figure 2). La génération de plaquettes procoagulantes dépend de l’afflux de calcium mitochondrial18,19 le long du gradient électrochimique à travers la membrane mitochondriale interne lors d’élévations cytosoliques du calcium induites par les agonistes ainsi que de la formation de pores de transition de perméabilité mitochondriale dépendante de la cyclophiline D (CypD)20. En consistance, l’augmentation de l’activité procoagulante induite par la thrombine était associée à une augmentation du calcium mitochondrial (Figure 3) et à une baisse du potentiel de membrane mitochondriale (Figure 4) mesurée à l’aide des colorants Rhod-2 et Mitotracker Red, respectivement. Les plaquettes stimulées présentent des caractéristiques d’apoptose, notamment l’accumulation de Bax/Bak21,22 ; la question de savoir si cela active la caspase23,24 et contribue à l’exposition au PS25 reste controversée. La stimulation par thrombine des plaquettes a été associée à l’activation de la caspase 8, mais pas des caspases terminales 3 et 7 (Figure 5), telles qu’analysées respectivement par FITC-IETD-FMK et le réactif de détection de l’apoptose.
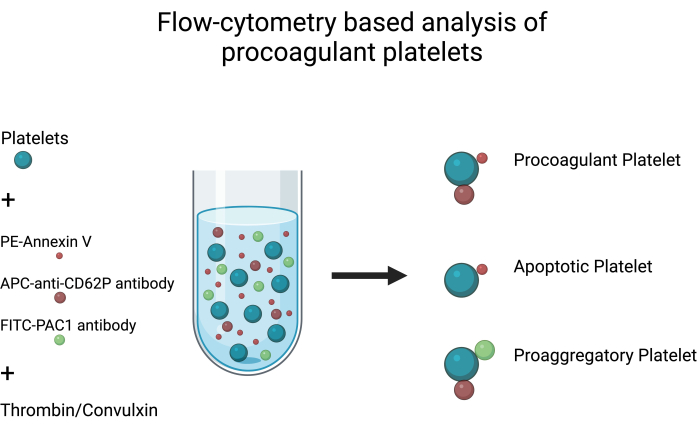
Figure 1 : Analyse des plaquettes procoagulantes. Schéma de principe illustrant l’analyse des plaquettes procoagulantes par cytométrie en flux à l’aide des anticorps FITC-PAC1, APC-anti-CD62P et PE-Annexine V comme sondes fluorescentes pour détecter l’activation de l’intégrine, l’expression de la P-sélectine et l’exposition à la PS, respectivement. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Expression de la sélectine P et exposition à la phosphatidylsérine dans les plaquettes lors de la stimulation de la thrombine. Diagrammes à points représentatifs montrant que les plaquettes étaient positives pour l’expression de la sélectine P et/ou l’exposition à la PS dans (A) les plaquettes non stimulées et lors de l’exposition à la thrombine à des doses de (B) 0,1 U/mL, (C) 0,25 U/mL et (D) 0,5 U/mL, détectées par fluorescence FITC-anti-CD62P et PE-Annexine V par cytométrie en flux. Les chiffres entre parenthèses indiquent la proportion de plaquettes totales dans chaque quadrant de la parcelle. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Modifications temporelles des taux de calcium mitochondrial dans les plaquettes lors de l’exposition à la thrombine. Graphiques de densité représentatifs montrant des changements de fluorescence en fonction du temps dus au colorant Rhod-2 indiquant les niveaux de calcium mitochondrial dans les plaquettes lors de l’exposition à la thrombine à des doses de (A) 0,1 U/mL, (B) 0,25 U/mL et (C) 0,5 U/mL détectées par cytométrie en flux. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Potentiel de la membrane mitochondriale dans les plaquettes lors de la stimulation de la thrombine. Cette figure montre des superpositions représentatives d’histogrammes illustrant la fluorescence due au colorant de marquage des mitochondries, indiquant le potentiel de membrane mitochondriale dans les plaquettes lors de l’exposition à différentes doses de thrombine, tel que détecté par cytométrie en flux. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Activités de la caspase 3/7 et de la caspase 8 dans les plaquettes lors de la stimulation de la thrombine. Des superpositions d’histogrammes représentatives montrant une fluorescence due à (A) un réactif de détection d’apoptose et (B) à FITC-IETD-FMK, respectivement, indiquant l’activité de la caspase 3/7 et de la caspase 8 dans les plaquettes lors de l’exposition à différentes doses de thrombine détectées par cytométrie en flux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Marqueur | Plaquettes procoagulantes | Plaquettes proagrégatives | Plaquettes apoptotiques |
| Activation de l’intégrine (liaison PAC1) | Non | Oui | Non |
| Sécrétion de granules | Oui | Oui | Non |
| (Expression de la p-sélectine) | |||
| Exposition PS | Oui | Non | Oui |
| (Annexe V contraignante) |
Tableau 1 : Marqueurs de cytométrie en flux pour l’identification des populations de plaquettes après stimulation. Ce tableau présente les marqueurs de cytométrie en flux utilisés pour détecter des populations distinctes de plaquettes qui émergent après stimulation de plaquettes avec des agonistes puissants tels que la thrombine et la convulxine.
Discussion
Les plaquettes procoagulantes présentent des augmentations marquées et soutenues du calcium intracellulaire lors de la stimulation26, mais peuvent être dérivées par différents mécanismes. Ils sont générés lors d’une forte stimulation agoniste avec du collagène et de la thrombine par l’intermédiaire de médiateurs distincts, y compris le plus important l’afflux de calcium mitochondrial18,19 le long du gradient électrochimique à travers la membrane mitochondriale interne lors d’élévations cytosoliques du calcium induites par les agonistes. Une fois que le calcium mitochondrial atteint un certain seuil, il active la formation de pores de transition de perméabilité mitochondriale (mPTP) d’une manière dépendante de la cyclophiline D (CypD)20. Lorsque les mitochondries sont perméabilisées au calcium et ne peuvent plus servir de puits pour le calcium cytosolique, une signalisation calcique supramaximale est observée après la formation de mPTP26. Les niveaux élevés soutenus de calcium cytosolique, à leur tour, activent l’activation de la TMEM16F phospholipide dépendante du calcium, conduisant à l’exposition au PS27,28. L’exposition au PS s’accompagne de l’inactivation de l’intégrineα IIbβ3 par un double mécanisme impliquant le clivage dépendant de la calpaïne de la queue cytoplasmique de l’intégrine β3 ainsi que le brouillage des phospholipides dépendants de l’TMEM16F29,30. Ainsi, les plaquettes procoagulantes, contrairement aux plaquettes pro-agrégatrices, ont une intégrine inactive. De plus, l’exposition au PS fournit une surface pour la liaison des facteurs de coagulation, facilitant l’assemblage des complexes ténase et prothrombinase3. Les plaquettes procoagulantes accélèrent ainsi considérablement la coagulation4.
L’exposition au PS et l’activité procoagulante qui en résulte peuvent également être induites par le clivage dépendant de la caspase de la scramblase XKR8 dans les plaquettes subissant une apoptose intrinsèque, indépendamment de l’activation25,31. Bien que les plaquettes stimulées présentent des caractéristiques d’apoptose intrinsèque, y compris l’accumulation de Bax/Bak21,22, la question de savoir si cela active la caspase23,24 et contribue à l’exposition à la PS25 reste controversée. L’apoptose extrinsèque par TNFα ou FasL n’a pas été signalée dans les plaquettes malgré la présence de la plupart des composants et certaines preuves de l’activation de la caspase 832. Les plaquettes lors d’une stimulation prolongée subissent une nécroptose17 médiée par MLKL, qui est connue pour induire une exposition à la PS indépendamment de la CypD ou de la caspase33.
Cette étude a fourni une méthode de détection des plaquettes procoagulantes en utilisant l’exposition au PS (liaison à l’annexine V), l’expression de la sélectine P (CD62P) et l’activation de l’intégrineα IIbβ3 (liaison PAC1) comme marqueurs. Ces marqueurs peuvent aider à distinguer efficacement les plaquettes procoagulantes des plaquettes apoptotiques et proagrégatrices15. Cependant, la liaison de l’annexine V nécessite la présence de niveaux élevés de calcium dans le milieu. Par conséquent, l’héparine ou d’autres inhibiteurs de la thrombine doivent être utilisés lors de l’utilisation d’échantillons de plasma riche en plaquettes ou de sang total. De plus, l’inhibiteur de la polymérisation de la fibrine GPRP est utilisé lorsque la thrombine doit être utilisée comme l’un des agonistes avec ces échantillons34,35. La lactadhérine ou GSAO peuvent être utilisés comme marqueurs alternatifs à l’annexine V, mais ils ont leurs propres limites. Bien que la lactadhérine ne soit pas spécifique à la PS et se lie aux intégrines36,37, la GSAO n’est pas disponible dans le commerce et ne peut être obtenue que par le biais d’une collaboration de recherche38.
Cet article a également fourni des méthodes supplémentaires pour étudier les mécanismes d’exposition au PS, y compris l’afflux de calcium mitochondrial et la formation de pores de transition de perméabilité mitochondriale (perte de potentiel de membrane mitochondriale). Il convient de noter ici que ces méthodes peuvent être complétées par des mesures de calcium cytosolique à l’aide de colorants Fluo-4 et Fluo-5N. Comme il n’est pas clair si l’activation de la caspase contribue à l’exposition à la PS dans les plaquettes stimulées, nous énumérons également les protocoles pour les tests d’activation de la caspase 8 et de la caspase 3/7. La véritable nature « procoagulante » des plaquettes ne peut être affirmée que par leur capacité à lier les facteurs de coagulation et à favoriser la génération de thrombine. Ainsi, une étude approfondie des plaquettes pour l’exposition au PS (liaison à l’annexine V), l’expression de la P-sélectine (CD62P) et l’activation de l’intégrine αIIbβ3 (liaison à PAC1), l’afflux de calcium mitochondrial, le potentiel de membrane mitochondriale, l’activité des caspases ainsi que la liaison au facteur de coagulation (prothrombine) et la génération/coagulation de la thrombine dépendante du phospholipide plaquettaire, comme décrit dans le présent article, serait nécessaire et suffisante pour une analyse complète des plaquettes procoagulantes.
Déclarations de divulgation
Les auteurs n’ont aucun intérêt concurrent à divulguer.
Remerciements
Paresh P. Kulkarni et Keith R. McCrae, respectivement, reconnaissent les bourses de boursier et de pilote financées par VeloSano, Cleveland Clinic Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Acid Citrate Dextrose (ACD) solution (For 1000 mL) | Tri- Sodium Citrate- 22 g Citric Acid- 8 g Dextrose- 24.5 g Water- Make up volume to 1000 mL | ||
| Alexa Fluor 488 protein labelling kit | Invitrogen | A10235 | |
| APC Mouse Anti-Human CD62P | BD Pharmingen | 550888 | |
| Bovine Prothrombin | Prolytix | BCP-1010 | |
| Buffer A (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 6.2 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution EGTA 1 mM Add 10 μL (1:100 v/v) 100 mM EGTA Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose PGE1 3 μM Add 3 μL (1:333 v/v) 1 mM PGE1 solution | ||
| Buffer B (Platelet Preparation) | M.W Conc. in 1X For 100 mL 10X solution HEPES 238.30 20 mM 4.766 g NaCl 58.44 134 mM 7.83 g KCl 74.55 2.9 mM 216.19 mg MgCl2 203.30 1 mM 203.30 mg NaH2PO4 156.01 0.34 mM 53.04 mg NaHCO3 84 01 12 mM 1.01 g Water to 100 mL after adjusting pH to 7.4 Dilute 10X solution 1:10 (v/v) with Milli Q water just before platelet preparation to obtain the 1X solution that needs to be supplemented with the following Conc. in 1X For 1 ml 1X solution Glucose 5 mM Add 5 μL (1:200 v/v) 1 M glucose | ||
| CaCl2 (0.5 M) (For 50ml) | Molecular weight of CaCl2.2H2O = 147.02 Dissolve 3.675 g of CaCl2.2H2O in 50 ml Milli Q water | ||
| CellEvent Caspase-3/7 Detection Reagents Green | Invitrogen | C10423 | Apoptosis detection reagent |
| Convulxin | Enzo Life Sciences | ALX-350-100 | |
| EDTA (0.5 M; pH 8) (For 100 mL) | Molecular Weight of EDTA Na2.2H2 O: 372.24g Weigh 18.612 g and suspend in 50 ml Milli Q water and check the pH (pH~4) Slowly add 10N NaOH with stirring and monitor the pH. EDTA starts solubilizing at around pH 7 and is completely soluble at pH 8. Make up the volume to 100 ml with Milli Q water. | ||
| EGTA (100 mM; pH 7.4) (For 100 mL) | Molecular Weight: 380.4 Add 3.804 g EGTA in 50 ml Milli Q water and check the pH (pH~3) Add 10 N NaOH dropwise while stirring and monitor the pH EGTA becomes soluble at pH 7.0 (approx) Adjust pH to 7.4 Make up the volume to 100 ml with Milli Q water | ||
| FITC Mouse Anti-Human PAC-1 | BD | 340507 | |
| FITC-IETD-FMK Caspase 8 (active) staining kit | Abcam | ab65614 | |
| Mitotracker Red CMXRos (mitochindria labeling dye) | Invitrogen | M7512 | Stock= 1 mM (50 µg dissolved in 90 µl DMSO) Sub-stock= 100 µM (10 µl Stock + 90 µl DMSO) Working concentration= 500nM (0.5 µl in 100 µl) |
| PE Annexin V | BD Pharmingen | 560930 | |
| Prostaglandin E1 | Sigma | P5515 | Stock= 20 mM (1 mg dissolved in 141 µL DMSO) Sub-stock= 1 mM (10 µl Stock + 190 µL DMSO) Working concentration= 3 µM (3 µL in 1 mL) |
| Rhod-2 AM | Invitrogen | R1244 | Stock= 5 mM (1 mg dissolved in 178 µL DMSO) Sub-stock= 100 µM (10 µL Stock + 90 µL DMSO) Working concentration= 500 nM (0.5 µL in 100 µL) |
| Thrombin from human plasma | Sigma | T7572 |
Références
- Munnix, I., Cosemans, J., Auger, J., Heemskerk, J. Platelet response heterogeneity in thrombus formation. Thromb Haemost. 102 (12), 1149-1156 (2009).
- Heemskerk, J. W. M., Mattheij, N. J. A., Cosemans, J. M. E. M. Platelet-based coagulation: Different populations, different functions. J Thromb Haemost. 11 (1), 2-16 (2013).
- Podoplelova, N. A., et al. Coagulation factors bound to procoagulant platelets concentrate in cap structures to promote clotting. Blood. 128 (13), 1745-1755 (2016).
- Mann, K. G., Butenas, S., Brummel, K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 23 (1), 17-25 (2003).
- Jackson, S. P., Schoenwaelder, S. M. Procoagulant platelets: Are they necrotic. Blood. 116 (12), 2011-2018 (2010).
- Hua Vivien Mun Yee, V. M. C. Procoagulant platelets and the pathways leading to cell death. Semin Thromb Hemost. 41 (04), 405-412 (2015).
- Dale, G. L. Coated-platelets: An emerging component of the procoagulant response. J Thromb Haemost. 3 (10), 2185-2192 (2005).
- Vulliamy, P., Armstrong, P. C. Platelets in hemostasis, thrombosis, and inflammation after major trauma. Arterioscler Thromb Vasc Biol. 44 (3), 545-557 (2024).
- Vulliamy, P., et al. Histone H4 induces platelet ballooning and microparticle release during trauma hemorrhage. Proc Natl Acad Sci U S A. 116 (35), 17444-17449 (2019).
- Aliotta, A., Bertaggia Calderara, D., Zermatten, M. G., Marchetti, M., Alberio, L. Thrombocytopathies: Not just aggregation defects-the clinical relevance of procoagulant platelets. J Clin Med. 10 (5), 894 (2021).
- Kirkpatrick, A. C., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets predict stroke at 30 days following TIA. Neurology. 89 (2), 125-128 (2017).
- Kirkpatrick, A. C., Tafur, A. J., Vincent, A. S., Dale, G. L., Prodan, C. I. Coated platelets improve prediction of stroke and transient ischemic attack in asymptomatic internal carotid artery stenosis. Stroke. 45 (10), 2995-3001 (2014).
- Suzuki, J., Umeda, M., Sims, P. J., Nagata, S. Calcium-dependent phospholipid scrambling by TMEM16F. Nature. 468 (7325), 834-838 (2010).
- Prodan, C. I., Vincent, A. S., Dale, G. L. Coated platelet levels correlate with bleed volume in patients with spontaneous intracerebral hemorrhage. Stroke. 41 (6), 1301-1303 (2010).
- Josefsson, E. C., et al. Consensus report on markers to distinguish procoagulant platelets from apoptotic platelets: Communication from the Scientific and Standardization Committee of the ISTH. J Thromb Haemost. 21 (8), 2291-2299 (2023).
- Kulkarni, P. P., Sonkar, V. K., Gautam, D., Dash, D. AMPK inhibition protects against arterial thrombosis while sparing hemostasis through differential modulation of platelet responses. Thromb Res. 196, 175-185 (2020).
- Ekhlak, M., et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 30 (8), 1886-1899 (2023).
- Kholmukhamedov, A., Janecke, R., Choo, H. -. J., Jobe, S. M. The mitochondrial calcium uniporter regulates procoagulant platelet formation. J Thromb Haemost. 16 (11), 2315-2321 (2018).
- Choo, H. -. J., Saafir, T. B., Mkumba, L., Wagner, M. B., Jobe, S. M. Mitochondrial calcium and reactive oxygen species regulate agonist-initiated platelet phosphatidylserine exposure. Arterioscler Thromb Vasc Biol. 32 (12), 2946-2955 (2012).
- Jobe, S. M., et al. Critical role for the mitochondrial permeability transition pore and cyclophilin D in platelet activation and thrombosis. Blood. 111 (3), 1257-1265 (2008).
- Leytin, V., Allen, D. J., Mykhaylov, S., Lyubimov, E., Freedman, J. Thrombin-triggered platelet apoptosis. J Thromb Haemost. 4 (12), 2656-2663 (2006).
- Lopez, J. J., Salido, G. M., Pariente, J. A., Rosado, J. A. Thrombin induces activation and translocation of Bid, Bax and Bak to the mitochondria in human platelets. J Thromb Haemost. 6 (10), 1780-1788 (2008).
- Wolf, B. B., et al. Calpain functions in a caspase-independent manner to promote apoptosis-like events during platelet activation. Blood. 94 (5), 1683-1692 (1999).
- Kim, O. V., et al. Fatal dysfunction and disintegration of thrombin-stimulated platelets. Haematologica. 104 (9), 1866-1878 (2019).
- Schoenwaelder, S. M., et al. Two distinct pathways regulate platelet phosphatidylserine exposure and procoagulant function. Blood. 114 (3), 663-666 (2009).
- Abbasian, N., Millington-Burgess, S. L., Chabra, S., Malcor, J. -. D., Harper, M. T. Supramaximal calcium signaling triggers procoagulant platelet formation. Blood Adv. 4 (1), 154-164 (2020).
- Le, T., et al. An inner activation gate controls TMEM16F phospholipid scrambling. Nat Commun. 10 (1), 1846 (2019).
- Yang, H., et al. TMEM16F forms a Ca2+-activated cation channel required for lipid scrambling in platelets during blood coagulation. Cell. 151 (1), 111-122 (2012).
- Mattheij, N. J. A., et al. Dual mechanism of integrin closure in procoagulant platelets. J Biol Chem. 288 (19), 13325-13336 (2013).
- Liu, F., et al. Mitochondrially mediated integrin αiIbβ3 protein inactivation limits thrombus growth. J Biol Chem. 288 (42), 30672-30681 (2013).
- van Kruchten, R., et al. Both TMEM16F-dependent and TMEM16F-independent pathways contribute to phosphatidylserine exposure in platelet apoptosis and platelet activation. Blood. 121 (10), 1850-1857 (2013).
- Goelz, N., et al. Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLOS ONE. 16 (1), e0244848 (2021).
- Shlomovitz, I., Speir, M., Gerlic, M. Flipping the dogma - phosphatidylserine in non-apoptotic cell death. Cell Commun Signal. 17 (1), 139 (2019).
- Nadine, J. A. M., et al. Coated platelets function in platelet-dependent fibrin formation via integrin αIIbβ3 and transglutaminase factor XIII. Haematologica. 101 (4), 427-436 (2016).
- Michelson, A. D. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: Methods and clinical applications. Blood Coagul Fibrinolysis. 5 (1), 121-131 (1994).
- Taylor, M. R., Couto, J. R., Scallan, C. D., Ceriani, R. L., Peterson, J. A. Lactadherin (formerly BA46), a membrane-associated glycoprotein expressed in human milk and breast carcinomas, promotes Arg-Gly-Asp (RGD)-dependent cell adhesion. DNA Cell Biol. 16 (7), 861-869 (1997).
- Andersen, M. H., Graversen, H., Fedosov, S. N., Petersen, T. E., Rasmussen, J. T. Functional analyses of two cellular binding domains of bovine lactadherin. Biochemistry. 39 (20), 6200-6206 (2000).
- Tan, C. W., Bourcy, M., Pasalic, L., Chen, V. M. Flow cytometry assessment of procoagulant platelets using a dithiol-reactive probe functional disulfide bonds: Methods and protocols. Methods Mol Biol. 1967, 305-321 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon