Method Article
Modèle murin de parodontite avancée induite par la ligature en nylon dans la deuxième molaire supérieure
Dans cet article
Résumé
Cette étude décrit une méthode modifiée de ligature du nylon 6-0 pour induire la parodontite chez la souris, qui est hautement reproductible et représente une alternative pour les chercheurs pour étudier la maladie parodontale de son développement à ses conséquences pathologiques.
Résumé
La maladie parodontale (MP) est un trouble inflammatoire affectant les tissus de soutien des dents et est l’une des maladies les plus répandues dans le monde. Sa forme sévère, la parodontite, entraîne la destruction des tissus mous, des dents et des os. Des modèles animaux de parodontite ont été développés à l’aide de primates, de chiens, de porcs miniatures et de souris. Parmi ceux-ci, le modèle murin induit par la ligature offre des avantages tels que la progression rapide de la maladie, la reproductibilité, la prévisibilité et le faible coût tout en reproduisant efficacement les aspects clés de la parodontite humaine. Des modèles murins utilisant des ligatures ont fourni des informations précieuses sur les microenvironnements microbiologiques et immunologiques du tissu parodontal, mettant en évidence le rôle critique des biofilms dans les réponses immunitaires et leur association avec les maladies systémiques. Cette étude présente une méthode modifiée de ligature du nylon pour induire la parodontite chez la souris. La modification consiste à utiliser une suture en nylon au lieu d’une suture en soie et à la placer sous la zone de contact interproximale plutôt que de la faire passer à travers le point de contact. Cette approche simplifie la technique tout en induisant efficacement la parodontite. La méthodologie détaillée de pose des sutures est illustrée graphiquement, et la progression de la parodontite est démontrée par des analyses histologiques et histométriques.
Introduction
La maladie parodontale (MP) est un trouble inflammatoire des tissus de soutien des dents et fait partie des maladies les plus répandues dans le monde1 ; l’incidence de la MP varie de 20 % à 50 % dans le monde2. La MP a différents degrés de progression ; sa forme bénigne, appelée gingivite, n’affecte que les tissus mous, et sa forme sévère, appelée parodontite (TP), affecte les tissus durs tels que l’os3. Étant donné que la physiothérapie est une maladie inflammatoire, elle doit être considérée comme une réponse immunitaire complexe qui peut être modifiée par plusieurs facteurs de risque qui peuvent modifier le processus de la maladie4, tels que le diabète sucré5, les maladies cardiovasculaires6, les interactions hormonales telles que les issues défavorables de la grossesse7 ou la prééclampsie8, les maladies inflammatoires9 et même les altérations oculaires10 ou la démence11.
Par conséquent, pour comprendre l’étiologie associée au développement ou à la prévalence de la physiothérapie, pour tester des stratégies thérapeutiques nouvelles ou plus efficaces, ou pour identifier une corrélation entre les maladies systémiques et la physiothérapie ou le microbiote parodontal, des modèles animaux sont nécessaires12.
Le choix d’une méthode de recherche efficace est crucial pour comprendre le développement de la physiothérapie et répondre adéquatement aux questions de recherche13. Au fil des ans, différents modèles animaux ont été développés pour l’étude de la physiothérapie ; Cependant, les modèles tels que les primates, les chiens, les lapins et les cochons miniatures sont coûteux et complexes à utiliser 14,15,16. Les modèles murins de TP, en particulier le modèle de PT induit par la ligature, présentent de nombreux avantages, notamment un développement rapide, une reproductibilité, une prévisibilité et un faible coût 17,18,19.
Bien que plusieurs méthodes soient utilisées pour induire la TP, telles que l’inoculation bactérienne orale, l’injection de lipopolysaccharides et l’induction de ligature 10,20, chacune présente des avantages et des inconvénients 17, le modèle murin de PT induit par la ligature en nylon ressemble au mécanisme humain pour son développement 20,21,22,23. Le PT se produit par la rétention du microbiote résident, provoquant une inflammation et entraînant une perte de tissus. De plus, les souris peuvent être génétiquement modifiées pour étudier différentes populations cellulaires ou molécules d’intérêt pour l’étude de la physiothérapie.
La ligature dentaire peut être réalisée à l’aide de différents matériaux, tels que des fils orthodontiques, des sutures en soie24,25 ou des sutures en nylon26. Le matériau le plus courant pour induire le PT par ligature chez la souris est la soie ; cette méthodologie a été expliquée par différents auteurs, tels que Marchesan et al.18, Abe et al.27 et Chadwick et al.22, chacun avec ses propres modifications, et toutes ces méthodes ont été utilisées avec succès par plusieurs chercheurs28. Cependant, la mise en place d’une suture en soie autour des molaires supérieures chez la souris peut être complexe. Marchesan et al. ont suggéré l’utilisation d’un « porte-ligature » ; Abe et al. et Chadwick et al. ont placé la suture à travers le point de contact, bien que Chadwick et al. l’aient placée autour des molaires M1 et M2.
Des sutures en nylon de différentes épaisseurs ont été utilisées pour le développement de la PT dans différents modèles animaux 29,30,31. Lima et coll.31 ont utilisé des sutures en nylon 5-0 ; Dans des études précédentes, nous avons utilisé des sutures en nylon 6-0 avec des résultats similaires28.
Par rapport aux sutures multifilaments, les sutures en nylon sont synthétiques monofilaments non résorbables et présentent une réponse tissulaire inflammatoire plus faible32 ; de plus, les sutures en nylon permettent également l’accumulation microbienne33,34, et il existe des preuves de l’adhésion de Fusobacterium nucleatum et de Porphyromona intermedia35,36, ainsi que des bactéries anaérobies facultatives dans les sutures en nylon 12,14,17,19,24,27,35,37 (Tableau 1).
Ces caractéristiques peuvent permettre à la réponse inflammatoire de se concentrer principalement sur l’accumulation bactérienne plutôt que sur l’accumulation de matériaux. De plus, le nylon a de meilleures propriétés mécaniques, telles que la résistance à la traction, que la soie38.
Par conséquent, dans la présente étude, la suture en nylon 6-0 placée autour de M2 sous la zone de contact interproximale a induit le développement d’une parodontite à un stade avancé chez la souris. Cette approche permet le placement de ligatures avec une pince à épiler ordinaire, et les résultats sont cohérents. Après 30 jours, le développement du PT peut être confirmé par une analyse histométrique et histologique.
Protocole
Toutes les procédures impliquant des animaux de laboratoire ont été menées dans le strict respect du « Cadre éthique pour la recherche biomédicale sur des animaux de laboratoire », conformément à la norme officielle mexicaine NOM-062-ZOO-1999. Cette étude a été approuvée par le comité d’éthique de la Facultad de Estudios Superiores Iztacala (FES-Iztacala) selon le protocole CE/FESI/072024/1765. Les souris ont été logées dans des chambres d’animaux avec un accès libre à la nourriture et à l’eau dans un environnement exempt d’agents pathogènes à l’animalerie FES-Iztacala. Ce protocole est une modification de la méthode précédemment décrite par Abe et al.27. Des souris femelles BALB/c âgées de six à huit semaines (pesant 16 g) ont été divisées en groupes témoins (CTL) et en groupes de parodontite (PT). La parodontite a été induite par la mise en place d’une suture en nylon 6-0 le jour 0 pour favoriser une adhésion bactérienne soutenue et déclencher une progression grave et chronique de la maladie. Après 30 jours, toutes les souris ont été euthanasiées (selon les protocoles approuvés par l’établissement) afin d’évaluer les lésions tissulaires et la perte d’attachement (LA) au moyen d’une analyse histométrique (figure 1). Les détails des réactifs et de l’équipement utilisés sont répertoriés dans la table des matériaux.
1. Préparation à l’anesthésie
- Préparez une dilution de xylazine et de kétamine (1:10) avec de l’eau injectable (stock). Conserver à 4 °C et utiliser dans les 4 semaines.
- Identifiez et pesez chaque souris. Préparez une dose de xylazine (1 mg/kg) et de kétamine (2 mg/kg) en fonction du poids pour une application intramusculaire à l’aide d’une seringue à insuline.
- Injecter 50 % de la dose totale de la solution anesthésique dans l’arrière-train. Répétez la procédure du côté opposé.
- Placez les souris dans une boîte profonde (10 cm³) et laissez-les s’endormir, ce qui prend environ 3 à 5 min.
- Prévenez la sécheresse oculaire et les lésions de la cornée dues à l’anesthésie en appliquant une goutte d’hypromellose sur chaque œil toutes les 15 minutes jusqu’à ce que les souris soient complètement réveillées et puissent cligner des yeux normalement.
REMARQUE : Les souris doivent être gardées en observation pendant 45 min, la durée approximative de l’anesthésie. Si une souris se réveille avant la fin de la procédure, celle-ci doit être suspendue et la souris doit être remplacée.
2. Positionnement des animaux
- Une fois la souris endormie, placez-la sur une table de travail face vers le haut, la tête vers l’opérateur. Tirez doucement chaque jambe sans tension et fixez-les avec du ruban adhésif microporeux pour éviter les mouvements involontaires soudains. Couvrez la souris avec une couverture ou une gaze pour maintenir la chaleur corporelle.
- Pour garder le museau ouvert, placez une extrémité d’un élastique orthodontique autour des incisives supérieures et fixez l’autre extrémité à un support supérieur sans tension. Placez un deuxième élastique orthodontique autour des incisives inférieures et fixez-le à un support inférieur avec un élastique.
- Placez les séparateurs de joues et déplacez délicatement la languette d’un côté pour une meilleure visibilité.
- Positionnez le microscope de manière à permettre une visualisation adéquate des molaires supérieures, en commençant par l’objectif de grossissement le plus bas. Une fois localisé, ajustez le grossissement pour assurer un confort et une mise au point optimaux pour l’opérateur.
3. Placement de la ligature
- Une fois que l’image est claire, identifiez les trois molaires supérieures : la plus grande molaire proximale (M1), la molaire suivante (M2) et la plus petite molaire distale (M3). Placez une suture en nylon 6-0, car son diamètre facilite la mise en place de la ligature et cause moins de dommages mécaniques aux tissus que les sutures plus larges.
- Localisez la face distale de M2, tenez l’extrémité de la suture en nylon 6-0 à l’aide d’une pince à épiler et placez l’extrémité à la base de la papille palatine. Appliquez une légère pression à travers la base de l’espace palatin interproximal vers la surface buccale (Figure 2A).
- Une fois que la suture en nylon 6-0 se croise, tirez-la à travers l’espace interproximal vers le côté buccal (Figure 2B).
- Placez l’extrémité de la suture en nylon 6-0 à la base de la zone interproximale à la surface mésiale de M2 du côté buccal. Poussez doucement l’extrémité de la suture pour la faire passer sous l’espace interproximal et passez-la à travers l’espace buccal jusqu’au palatin (Figure 2C).
- Tirez doucement sur la suture en nylon 6-0, tenez l’extrémité à l’aide d’une pince à épiler, ajustez-la autour de M2 et fixez la suture avec trois nœuds simples.
- Coupez la suture en nylon 6-0 avec des ciseaux fins (figure 2D).
4. Récupération des animaux
- Pour libérer la souris, retirez les séparateurs de joues, le ruban adhésif microporeux des jambes et les élastiques orthodontiques. Tout d’abord, retirez l’élastique autour des incisives inférieures, puis retirez l’élastique autour des incisives supérieures.
- Retirez la souris de la table de travail, enveloppez-la dans de la gaze ou un chiffon et placez-la face vers le haut. Maintenez la langue sur le côté pour garder les voies respiratoires ouvertes et éviter le blocage.
- Gardez l’animal au chaud, recouvert d’un chiffon ou d’une gaze, et sous observation jusqu’à ce qu’il soit complètement réveillé. Ensuite, placez-les dans leurs cages habituelles.
- Appliquez une goutte d’hypromellose dans chaque œil jusqu’à ce que la souris puisse cligner normalement.
- Gardez l’animal dans des conditions standard.
5. Contrôle de la ligature
- Vérifiez la permanence de la ligature en nylon chaque semaine (Figure 3A,B).
- Prenez la souris, tenez fermement la tête et le corps et utilisez une pince à épiler pour ouvrir le museau. Observez la suture en nylon 6-0 autour de M2 à la lumière d’une lampe.
- Établir le développement de la maladie parodontale basée sur l’accumulation de biofilm et l’irritation mécanique. Vérifiez cela par une analyse histologique.
6. Histologie
- Après 30 jours, euthanasier les souris dans une chambre de CO2 (selon les protocoles approuvés par l’établissement). Récoltez les maxillaires comme indiqué précédemment39. Lavez les tissus récoltés dans une solution de NaCl à 0,9 % et placez-les dans de nouveaux tubes de microcentrifugation étiquetés.
- Fixer les échantillons dans une solution de paraformaldéhyde à 4 % pendant 2 h en agitant.
- Lavez les échantillons à l’eau du robinet pendant 2 h.
- Pour éliminer les minéraux de l’os et préparer des coupes de paraffine de haute qualité, détartrez les échantillons en vingt volumes d’une solution d’EDTA à 4 % (pH 7,3) pendant 20 jours dans des tubes de microcentrifugation, changez l’EDTA tous les 4 jours40.
- Intégrez les échantillons dans de la paraffine. Coupez des sections de 5 μm de la zone M2 et colorez-les avec de l’hématoxyline et de l’éosine (H&E)41.
7. Analyse des données
- Observez les coupes histologiques colorées au microscope optique pour effectuer une analyse descriptive des changements dans la configuration de l’épithélium du sillon, des fibres gingivales, des fibres parodontales, de la hauteur et de l’intégrité de la crête alvéolaire.
- Déterminez la perte d’attachement (LA) en mesurant la distance entre la jonction cémento-émail (CEJ) et le point le plus élevé de la crête osseuse. Tracez une ligne entre ces deux points à l’aide d’un programme d’édition numérique. Effectuer une analyse histométrique sur les surfaces buccale et palatine selon la méthodologie décrite par Semenoff et al.42 (Figure 4).
8. Analyse statistique
- Analyser les données obtenues des groupes CTL et PT à l’aide du test U de Mann-Whitney. Considérons p < 0,05 comme statistiquement significatif. Utilisez des statistiques et des logiciels graphiques pour l’analyse.
Résultats
Cette méthodologie permet aux souris induites de développer une parodontite (TP) à partir de la deuxième semaine. Les souris ont été surveillées chaque semaine pour vérifier la présence de la ligature. L’euthanasie a été pratiquée le 30e jour. Les caractéristiques cliniques de tous les groupes ont été évaluées. Le groupe témoin a maintenu des caractéristiques normales, telles que la couleur et la structure de la gencive marginale, au fil du temps. Par rapport à ceux du groupe CTL, les tissus du groupe PT ont montré une inflammation, des saignements et la formation de poches parodontales, qui ont été observées à la marge gingivale chez les souris induites (Figure 5).
L’évolution de la maladie a été confirmée par la réalisation d’une analyse histologique et histométrique de l’AL du tissu parodontal de M2 dans les deux groupes. Le groupe CTL présentait des caractéristiques histologiques ressemblant à celles des tissus sains : l’épithélium de la gencive marginale et du sillon, les fibres gingivales (Figure 6A, CTL flèche bleue), l’épithélium jonctionnel et la crête alvéolaire (Figure 6A, CTL flèche verte) ; les fibres du tissu conjonctif étaient dans une position et une hauteur normales ; Les fibres de Sharpey étaient intactes lors de leur insertion dans l’os alvéolaire et le cément radiculaire ; et une épaisseur symétrique autour de la racine (figure 6A, flèche orange CTL) a été observée, en particulier à l’attache dans les vues buccale et palatine. Les noyaux cellulaires des fibres du ligament parodontal (LDP), du tissu conjonctif et des ostéocytes de l’os alvéolaire étaient clairement visibles (40x). Dans le groupe PT, les tissus parodontaux présentaient des lésions sévères, avec la présence de poches parodontales, caractérisées par une perte de la crête alvéolaire (Figure 6A, PT, flèche verte), une migration apicale de l’épithélium et un détachement des fibres de Sharpey à la surface de la racine (Figure 6A, PT, flèche orange). Dans le tissu conjonctif, la gencive et l’os des côtés buccal et palatin étaient dépourvus de noyaux cellulaires (Figure 6A, PT, flèche bleue), qui sont tous caractéristiques de la maladie parodontale.
L’analyse histométrique a révélé que, pour le groupe CTL, la position de la crête osseuse était constante des deux côtés : buccale et palatine. De plus, par rapport au groupe CTL, le groupe PT présentait une augmentation significative de la profondeur de la surface buccale (p = 0,0001, 117,5 nm ± 6 vs 209,17 nm ± 10) en raison de la perte de tissu. Par rapport à celle du groupe CTL, la surface palatine du groupe PT était significativement plus grande (p = 0,03, 175,25 nm ± 8 vs 254,03 nm ± 50). Bien que les deux côtés aient présenté une destruction tissulaire, elle était plus évidente sur la surface palatine, avec une plus grande profondeur et une plus grande perte d’attachement, que sur la surface buccale (Figure 6B,C). Ces résultats sont cohérents avec nos résultats précédemment publiés qui montraient un comportement similaire28.
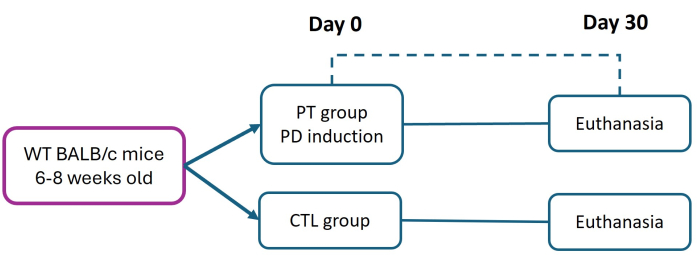
Figure 1 : Conception expérimentale. La parodontite (TP) a été induite chez des souris BALB/c âgées de six à huit semaines (16 g) à l’aide du modèle de ligature en nylon 6-0 (jour 0). Trente jours après l’induction, des souris PT et saines (CTL) ont été euthanasiées pour une évaluation des tissus parodontaux. Trois expériences indépendantes ont été réalisées ; le nombre total de souris dans les groupes CTL et PT était de n = 9. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Procédure étape par étape pour la mise en place de la ligature afin d’induire une parodontite. Images représentatives de la séquence d’étapes utilisées pour induire la parodontite dans la deuxième molaire supérieure de la souris : (A) montre comment la suture en nylon 6-0 est insérée distale à M2, du palatin à la buccale ; (B) montre comment la pression doit être appliquée doucement sous la zone de contact ; (C) montre comment la suture en nylon doit passer à travers la partie mésiale de M2, du palatin à la buccale ; et (D) montre comment la suture en nylon est ajustée autour de M2 et fixée avec un triple nœud pour agir comme une ligature. Veuillez cliquer ici pour voir une version agrandie de cette figure.
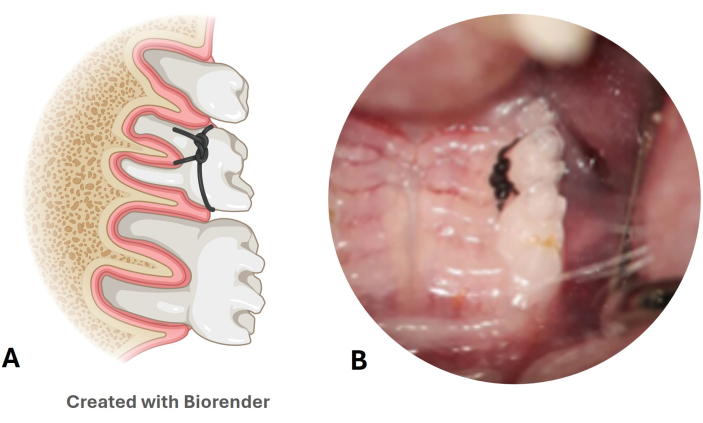
Figure 3 : Modèle de maladie parodontale par ligature en nylon. (A) Illustration de la position de la ligature dans la deuxième molaire supérieure. (B) Image de la ligature en nylon placée dans un modèle de souris. Veuillez cliquer ici pour voir une version agrandie de cette figure.
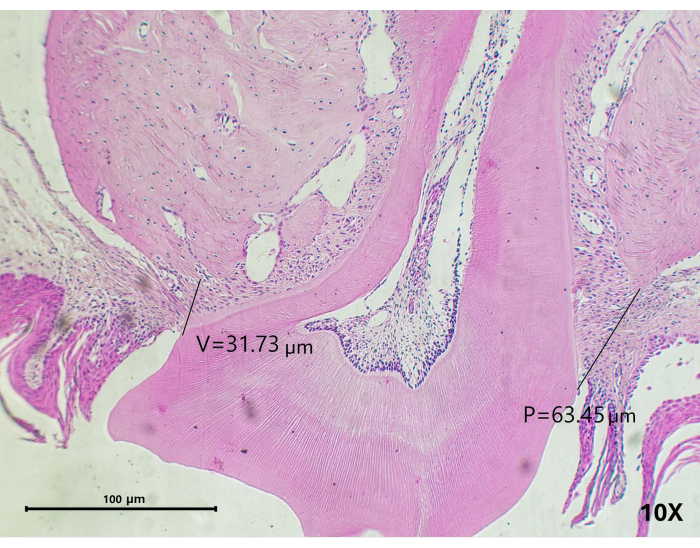
Figure 4 : Analyse histométrique. La perte d’attachement (LA) a été déterminée en tenant compte de la distance entre la jonction cémento-émaillée (CEJ) et le point le plus proche de la crête alvéolaire, en traçant une ligne entre les deux points sur les surfaces buccale et palatine. Pour référence : V(B) : buccal, P palatal. Grossissement : 10x ; barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Développement des signes cliniques de parodontite chez les souris WT. Image clinique représentative des tissus parodontaux, contrôle des CTL ; PT, maladie parodontale jour 1 après la pose de la suture en nylon 6-0 ; Jour 30 après l’ablation de la suture. Des images représentatives de trois expériences indépendantes ont été réalisées ; le nombre total de souris dans les groupes CTL et PT était de n = 9. Veuillez cliquer ici pour voir une version agrandie de cette figure.
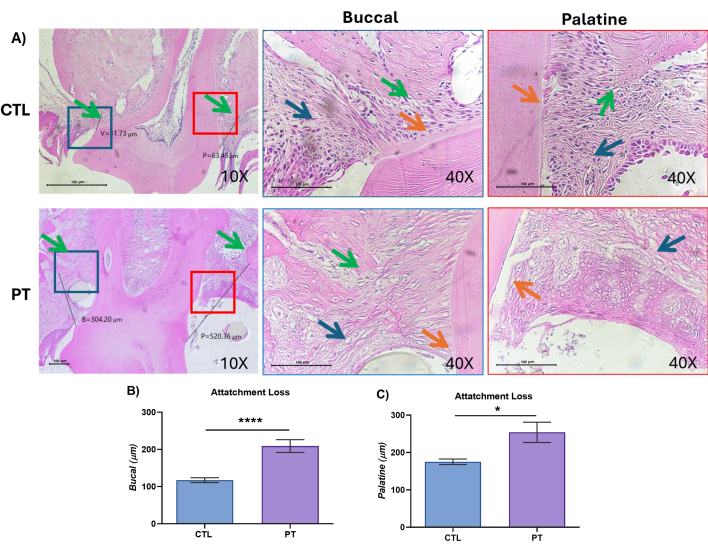
Figure 6 : Les tissus parodontaux ont montré une perte d’attachement et des lésions tissulaires dans le modèle de parodontite induit par le nylon. (A) Images histologiques représentatives avec coloration H&E des tissus parodontaux, contrôle (CTL) ; parodontite (PT), panneau gauche 10x, l’analyse histométrique est représentée, avec une ligne allant de la jonction cémento-émaillée (CEJ) au bord de la crête alvéolaire, buccale (B), palatine (P), indiquée dans la boîte bleue buccale rouge palatine. Panneaux droits buccal et palatin à grossissement rapproché à 40x. Flèche bleue, tissu conjonctif ; flèche orange, insertion du ligament parodontal dans le ciment radiculaire ; flèche verte, crête en os. Barres d’échelle = 100 μm. (B, C) Analyse histométrique du CEJ et du point le plus haut de la crête alvéolaire. Une image représentative de trois expériences indépendantes a été réalisée ; le nombre total de souris dans les groupes CTL et PT était de n = 9. Les données sont exprimées comme les moyennes ± MEB, et les valeurs de *p < 0,05 et ****p < 0,0001 ont été considérées comme statistiquement significatives selon le test U de Mann-Whitney. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Matériel | Induction | Avantages | Inconvénients |
| Soie | Passage dans l’espace interproximal | Adhérence bactérienne élevée | Nécessite des compétences pour l’insertion |
| Suture multifilament | Facilement déchiré | ||
| Origine naturelle | Perte de ligature | ||
| Fil orthodontique | Insertion dans la zone interdentaire | Plus facile à placer | Besoin d’une insertion soigneuse pour éviter d’endommager les tissus |
| Résistant | |||
| Nylon | Insertion sous le point de contact | Plus facile à placer | Nécessite un grossissement |
| Pas de dommages tissulaires causés par le matériau | Le nœud peut être déplacé | ||
| Résistant et flexible | |||
| Adhérence des bactéries parodontales |
Tableau 1 : Différents matériaux utilisés pour induire une maladie parodontale par ligature chez la souris.
Discussion
Plusieurs modèles animaux de parodontite ont été utilisés pour évaluer différents aspects, tels que les réponses microbiologiques et immunitaires, et présentent certaines similitudes avec la maladie humaine43. Ces résultats fournissent des preuves du cadre de la maladie parodontale, comme le rôle des biofilms, la réponse immunitaire et les interactions avec les affections systémiques44,45.
Les modèles animaux de parodontite ont des complexités et des similitudes différentes ; Par exemple, les primates non humains, les chiens ou les porcs miniatures sont les plus similaires à la maladie parodontale humaine19, bien que le coût et les exigences pour les manipuler et les entretenir rendent ces modèles peu pratiques. De plus, les modèles murins de parodontite sont moins coûteux et plus faciles à manipuler. De plus, les souris peuvent être génétiquement modifiées pour générer une molécule ou une cellule d’intérêtspécifique 46, et la méthodologie est bien établie47.
Bien que les souris ne développent pas naturellement le PT, il peut être induit par différentes méthodologies ; Le modèle le plus couramment utilisé est le modèle induit par la ligature, qui est hautement reproductible22,23, car plusieurs matériaux ont été utilisés, tels que le fil orthodontique, la soie ou le nylon, entre autres.
En particulier, le nylon peut être une option viable pour induire la PT ; en raison de certaines de ses caractéristiques, en tant que monofilament synthétique, il a une réponse tissulaire minimale et permet l’adhésion de bactéries parodontales telles que Fusobacterium nucleatum et Porphyromona intermedia35,36. Cela permet à la réponse inflammatoire de conduire à une accumulation bactérienne « normale ».
Cette étude propose une alternative pour développer la PT via l’utilisation d’une suture en nylon 6-0 comme modèle d’induction, et nous avons analysé les données cliniques et histologiques de souris CTL et PT. Nous avons identifié les caractéristiques des marges gingivales présentes dans le groupe PT, telles que les saignements, l’inflammation et la formation de poches parodontales. Ces observations ont été corroborées par une analyse histométrique. En particulier, le degré de perte de PT était significativement différent ; Bien que les surfaces buccale et palatine aient montré une destruction tissulaire, elle était plus importante sur la surface palatine. C’est probablement parce que la paroi buccale est plus large chez la souris que chez l’homme.
Lima et al.31 ont rapporté que les ligatures en nylon induisaient la PT ; Bien qu’ils aient utilisé une suture 5-0, ils ont placé le nœud sur la surface buccale et ont mesuré la perte osseuse linéaire de 6 micro-CT après 15 jours. Bien que des sutures en nylon 6-0 aient été utilisées, le nœud a été placé sur la surface palatine et une analyse histométrique a été effectuée après 30 jours pour induire une physiothérapie sévère. Les résultats ont révélé que les sutures en nylon 6-0 autour de M2 ont entraîné une PT. Liberman et al. n’ont signalé aucune différence entre les méthodes utilisées pour évaluer la perte osseuse48.
Ces résultats montrent que le modèle proposé est reproductible et présente plusieurs avantages. Tout d’abord, il est plus facile à utiliser car il est similaire à l’utilisation d’un enfileur ; Ainsi, il ne pousse pas nécessairement la suture vers l’espace interproximal, ce qui augmente le risque de blessure à la cavité buccale de la souris en raison de l’espace limité. Deuxièmement, ce modèle permet le développement de la PT par l’accumulation de biofilms de manière naturelle et induit une inflammation chronique dans les tissus parodontaux.
Ce modèle présente plusieurs limites, notamment la courbe d’apprentissage, la nécessité d’aides visuelles et les défis associés à l’utilisation de microscopes ou de loupes. De plus, il existe la possibilité de perdre les nœuds et les ligatures, ce qui rend indispensable de vérifier la permanence de la ligature pour assurer la présence continue du stimulus irritant.
En résumé, ce protocole décrit les étapes nécessaires à l’établissement d’un modèle robuste de PT avancé induit par une suture en nylon 6-0, qui facilite la mise en place de la ligature. Il détaille également la méthodologie d’administration de l’anesthésique, d’amplification et d’évaluation de la perte d’attachement. De plus, ce modèle peut être utilisé pour étudier les mécanismes spécifiques de l’hôte impliqués dans la perte osseuse inflammatoire due à la TP, ainsi que le rôle de la TP dans le développement de maladies ou de troubles d’origine infectieuse, néoplasique, auto-immune ou hormonale. Par conséquent, l’utilisation de ce modèle pour étudier la physiothérapie causée par l’accumulation de biofilm et l’inflammation a le potentiel de générer des connaissances fondamentales ayant des implications thérapeutiques et d’améliorer le diagnostic.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas de conflit d’intérêts concernant la publication de cet article.
Remerciements
Ce travail a été financé en partie par le Conseil pour la science et la technologie de l’État de Mexico (COMECYT) numéro de subvention [FICDTEM-2021-072] et le Programme de soutien aux projets de recherche et d’innovation technologique (PAPIIT)-UNAM, numéro de subvention [IN-217021]. Nous remercions le programme de spécialisation en endoperiodontología, FES Iztacala, UNAM pour les installations fournies pour réaliser cette vidéo et Rosalba Yañez Ortiz, DDS, pour son soutien dans la réalisation de cette vidéo. Certaines figurines ont été créées avec le programme Biorender (numéro d’entente ME282NWCI1).
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl solution | PiSA | Rinse maxillae | |
| 6-0 nylon suture | Atramat, Internacional Farmacéutica | PE1946-N | Ligature placement |
| Amscope 3.7 program for digital camera | Amscope | x64, 4.11.21973.20230107 | Data colection |
| EDTA solution | Sigma–Aldrich | E5134 | Decalcification |
| Fine scissors | generic | To cut the 6-0 nylon suture | |
| Fine tweezers | generic | 6-0 nylon suture | |
| Gauze pad | generic | To keep corporal tempature | |
| GraphPad Prism | GraphPad Prism | Version 8.3.0 | Data analysis |
| Hypromellose | generic | Eye lubricant | |
| Injectable water | Pisa | Dilution of anesthetic solution | |
| Ketamine | Anesket, Pisa | Anesthetic | |
| Micro centrifuge tubes | Cellpro | 801501 | To contain tissues durin decalcification |
| Micropore | 3M | 1533 | To fix mouse |
| Microscope digital camera | Amscope | MU1603 | Histology |
| Microtubes | Axygen | MCT-150-C | Store anesthetic dilution |
| Optical microscope | UNICO | Serie G380 | Histology |
| Orhodontic elastics | TP Orthodintics, Inc | blue | To keep the snout open |
| Paraformaldehyde solution | Sigma–Aldrich | 158127 | Tissue Fixation |
| Paraplast | Leica | 39601006 | Histology |
| Surgical microscope | Carl Zeiss GmbH Berlin | 6-0 nylon suture | |
| Ultra Fine Insulin Syringes 6mm U-100, 0.3 mL | BD | 326385 | To inject the anesthetic solution |
| Universal rubber bands | generic | To keep the snout open | |
| Worktable | Generic | Wooden base to support mice | |
| Xylazine | Porcin, Pisa | Preanesthetic |
Références
- Nazir, M., et al. Global prevalence of periodontal disease and lack of its surveillance. Sci World J. 2020 (1), 2146160(2020).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 44 (5), 456-462 (2017).
- Caton, J. G., et al. A new classification scheme for periodontal and peri-implant diseases and conditions - introduction and key changes from the 1999 classification. J Clin Periodontol. 45 (Suppl 20), S1-S8 (2018).
- Harrel, S. K., Cobb, C. M., Sottosanti, J. S., Sheldon, L. N., Rethman, M. P. Clinical decisions based on the 2018 classification of periodontal diseases. Compend Contin Educ Dent. 43 (1), 52-56 (2022).
- Stöhr, J., Barbaresko, J., Neuenschwander, M., Schlesinger, S. Bidirectional association between periodontal disease and diabetes mellitus: A systematic review and meta-analysis of cohort studies. Sci Rep. 11 (1), 13686(2021).
- Sanz, M., et al. Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol. 47 (3), 268-288 (2020).
- Figuero, E., Han, Y. W., Furuichi, Y. Periodontal diseases and adverse pregnancy outcomes: Mechanisms. Periodontol 2000. 83 (1), 175-188 (2000).
- Jung, E., et al. The etiology of preeclampsia. Am J Obstet Gynecol. 226 (2s), S844-S866 (2022).
- Hajishengallis, G., Chavakis, T. Local and systemic mechanisms linking periodontal disease and inflammatory comorbidities. Nat Rev Immunol. 21 (7), 426-440 (2021).
- Arjunan, P., et al. Exacerbation of AMD phenotype in lasered CNV murine model by dysbiotic oral pathogens. Antioxidants. 10 (2), 309(2021).
- Ma, K. S., et al. Dementia and the risk of periodontitis: A population-based cohort study. J Dent Res. 101 (3), 270-277 (2022).
- Hajishengallis, G. Illuminating the oral microbiome and its host interactions: Animal models of disease. FEMS Microbiol Rev. 47 (3), fuad018(2023).
- Hajishengallis, G., Lamont, R. J., Graves, D. T. The enduring importance of animal models in understanding periodontal disease. Virulence. 6 (3), 229-235 (2015).
- Weinberg, M. A., Bral, M. Laboratory animal models in periodontology. J Clin Periodontol. 26 (6), 335-340 (1999).
- Shanbhag, S., et al. Peri-implant bone regeneration in pigs. Int J Implant Dent. 10 (1), 55(2024).
- Do, M. J., et al. Development of animal experimental periodontitis models. J Periodontal Implant Sci. 43 (4), 147-152 (2013).
- Khuda, F., Baharin, B., Anuar, N. N. M., Satimin, B. S. F., Nasruddin, N. S. Effective modalities of periodontitis induction in rat model. J Vet Dent. 41 (1), 49-57 (2024).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Martuscelli, G., Fiorellini, J. P., Crohin, C. C., Howell, T. H. The effect of interleukin-11 on the progression of ligature-induced periodontal disease in the beagle dog. J Periodontol. 71 (4), 573-578 (2000).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), 8900(2021).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Chadwick, J. W., Glogauer, M. Robust ligature-induced model of murine periodontitis for the evaluation of oral neutrophils. J Vis Exp. (155), e59667(2020).
- De Almeida, K., et al. Identification of microRNAs expressed in an animal model of periodontal disease and their impact on pathological processes. Tissue Cell. 90, 102525(2024).
- Yoon, H., et al. Temporal changes of periodontal tissue pathology in a periodontitis animal model. J Periodontal Implant Sci. 53 (4), 248-258 (2023).
- Benzen, B. H., et al. A comparison of two models of experimental periodontitis in rats. Scand J Lab Anim Sci. 32 (2), 73-80 (2005).
- Franca, L. F. C., et al. Periodontitis changes renal structures by oxidative stress and lipid peroxidation. J Clin Periodontol. 44 (6), 568-576 (2017).
- Abe, T., Hajishengallis, G. Optimization of the ligature-induced periodontitis model in mice. J Immunol Methods. 394 (1-2), 49-54 (2013).
- Ortiz-Sánchez, B. J., et al. Periodontitis exacerbation during pregnancy in mice: Role of macrophage migration inhibitory factor as a key inductor. J Periodontal Res. 59 (2), 267-279 (2023).
- Lu, H., et al. Chronic stress accelerates ligature-induced periodontitis by suppressing glucocorticoid receptor-α signaling. Exp Mol Med. 48 (3), e223(2016).
- França, A. L. Q., et al. Molecular docking study and antireabsorptive activity of a semi-synthetic coumarin derivative from Platymiscium floribundum in the ligature-induced periodontitis in rats: The involvement of heme oxygenase-1. Clin Oral Investig. 26 (2), 1701-1711 (2022).
- Lima, M. L. S., et al. The receptor at1 appears to be important for the maintenance of bone mass, and at2 receptor function in periodontal bone loss appears to be regulated by at1 receptor. Int J Mol Sci. 22 (23), 12849(2021).
- Faris, A., et al. Characteristics of suture materials used in oral surgery: Systematic review. Int Dent J. 72 (3), 278-287 (2022).
- Nadafpour, N., Montazeri, M., Moradi, M., Ahmadzadeh, S., Etemadi, A. Bacterial colonization on different suture materials used in oral implantology: A randomized clinical trial. Front Dent. 18, 25(2021).
- Naghsh, N., Yaghini, J., Arab, A., Soltani, S. Comparison of the number of bacterial colonies among four types of suture threads using simple loop method following periodontal surgery in patients with periodontitis: A single-blind randomized clinical trial. Dent Res J (Isfahan). 20, 71(2023).
- De Castro Costa Neto, O., et al. Oral bacteria adherence to suture threads: An in vitro study. Oral Maxillofac Surg. 19 (3), 275-280 (2015).
- Asher, R., Chacartchi, T., Tandlich, M., Shapira, L., Polak, D. Microbial accumulation on different suture materials following oral surgery: A randomized controlled study. Clin Oral Investig. 23 (2), 559-565 (2019).
- Banche, G., et al. Microbial adherence on various intraoral suture materials in patients undergoing dental surgery. J Oral Maxillofac Surg. 65 (8), 1503-1507 (2007).
- Kaur Randhawa, R., et al. Assessment of the mechanical properties of different suture materials for oral surgery: An in vitro tensile strength study. Cureus. 16 (8), e65952(2024).
- Liu, Y., et al. Using inducible osteoblastic lineage-specific stat3 knockout mice to study alveolar bone remodeling during orthodontic tooth movement. J Vis Exp. (197), e65613(2023).
- Wang, S. K., et al. Itgb6 loss-of-function mutations cause autosomal recessive amelogenesis imperfecta. Hum Mol Genet. 23 (8), 2157-2163 (2014).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin-embedded blocks. Methods Mol Biol. 1897, 253-268 (2019).
- Semenoff, T. A., et al. Histometric analysis of ligature-induced periodontitis in rats: A comparison of histological section planes. J Appl Oral Sci. 16 (4), 251-256 (2008).
- Oz, H. S., Puleo, D. A. Animal models for periodontal disease. J Biomed Biotechnol. 2011, 754857(2011).
- Zhao, P., Xu, A., Leung, W. K. Obesity, bone loss, and periodontitis: The interlink. Biomolecules. 12 (7), 865(2022).
- Graves, D. T., Corrêa, J. D., Silva, T. A. The oral microbiota is modified by systemic diseases. J Dent Res. 98 (2), 148-156 (2019).
- Yoshimi, K., Mashimo, T. Application of genome editing technologies in rats for human disease models. J Hum Genet. 63 (2), 115-123 (2018).
- Vandamme, T. F. Rodent models for human diseases. Eur J Pharmacol. 759, 84-89 (2015).
- Liberman, D. N., Pilau, R. M., Orlandini, L. F., Gaio, E. J., Rösing, C. K. Comparison of two methods for alveolar bone loss measurement in an experimental periodontal disease model in rats. Braz Oral Res. 25 (1), 80-84 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon