Method Article
Protocolos experimentales de cribado, inmunocitoquímica y técnicas de imagen basadas en microscopía para Penium margaritaceum
En este artículo
Resumen
Este informe describe los métodos fundamentales utilizados para cultivar y manipular experimentalmente el alga estreptofita unicelular, Penium margaritaceum. También proporciona protocolos fundamentales de imágenes basadas en microscopía, incluido el marcaje de células vivas con anticuerpos monoclonales y otras sondas fluorescentes y microscopía electrónica de barrido.
Resumen
La pared celular es el primer componente de la recepción/transducción de señales para una célula vegetal durante el desarrollo y cuando responde a factores abióticos y bióticos ambientales. La célula monitorea constantemente la integridad de su pared celular y la modula en respuesta al estrés. Dilucidar las modulaciones estructurales y bioquímicas específicas que ocurren en la pared celular es una tarea difícil, especialmente cuando se emplean plantas multicelulares y sus órganos/tejidos. Esto se debe a los límites en cuanto a lo que se puede resolver en una célula individual que forma parte de una red multicelular compleja. El alga estreptofita unicelular, Penium margaritaceum, se ha utilizado recientemente en investigaciones sobre la dinámica de la pectina, la plasticidad fenotípica basada en la pared celular y múltiples aspectos de la biología celular de las algas. Su fenotipo simple, su pared celular distintiva que tiene muchos componentes notablemente similares a las paredes celulares de las plantas terrestres y su facilidad en los estudios inmunocitoquímicos y experimentales lo convierten en un poderoso organismo modelo en la biología de la pared celular de las plantas. El objetivo de este estudio es proporcionar las técnicas básicas para el cultivo, la manipulación experimental y la detección de los factores estresantes aplicados. Protocolos de cribado para inmunocitoquímica, imágenes de microscopía de barrido láser confocal e imágenes de microscopía electrónica de barrido de la estructura de la pared celular. Del mismo modo, muchas de las técnicas descritas pueden modificarse para una amplia gama de otros estudios celulares y moleculares.
Introducción
La pared celular de una planta es una red polimérica compleja que tiene múltiples funciones en la vida de una célula vegetal1. La integridad de la pared celular es monitoreada constantemente por la célula durante el desarrollo y en respuesta al estrés ambiental y, modula en química y estructura en consecuencia. Penium margaritaceum es un alga verde unicelular que ha sido utilizada recientemente en estudios de algas estreptofitas (Streptophyta, el grupo de algas verdes más estrechamente relacionadas y ancestrales de las plantas terrestres2).
Durante las últimas dos décadas, P. margaritaceum ha sido un organismo importante en las investigaciones de la pared celular y la dinámica de la matriz extracelular, las actividades del sistema de endomembranas, la manifestación de la forma de las células y la evolución de las plantas 3,4,5,6,7,8,9,10,11 . El objetivo de este trabajo es proporcionar a los investigadores de la pared celular de las plantas los métodos fundamentales para cultivar P. margaritaceum, manipularlo experimentalmente utilizando técnicas basadas en microplacas y monitorear la estructura de su pared celular utilizando el marcaje inmunocitoquímico de células vivas y la imagen con técnicas de microscopía óptica y electrónica. P. margaritaceum tiene muchas similitudes en la bioquímica de la pared celular con las paredes celulares primarias de las plantas terrestres. Hemos ideado múltiples protocolos que aprovechan el fenotipo unicelular único de esta alga y proporcionan un medio rápido para estudiar la dinámica de la pared celular que a menudo es difícil de monitorear en plantas multicelulares. Estas técnicas serán de ayuda para los biólogos de la pared celular de las plantas que deseen dilucidar la dinámica detallada de la pared celular, especialmente los que se ocupan de la pectina, y servirán como punto de partida para los estudios relacionados con la biología celular de las plantas y las algas estreptofitas.
Protocolo
NOTA: Penium margaritaceum se obtiene en el Sammlung von Algenkulturen der Universität Göttingen - Colección de Cultivos de Algas de la Universidad de Göttingen, SAG; Cepa #2640.
1. Mantenimiento de las culturas
- Mantenga el alga en un medio líquido Woods Hole (WH12) que también se puede complementar con extracto de agua del suelo (es decir, 40 mL por L de medio). Mantener los cultivos a 20-25 °C con un ciclo de luz: oscuridad de 16 h:8 h con 3,5 klux (74 μmol fotones/m2/s) de luz fluorescente blanca fría.
- Prepare los subcultivos semanalmente y utilice cultivos celulares cuando tengan entre 10 y 14 días de edad. Los cultivos de penio serán viables durante 6 meses y se pueden utilizar para iniciar subcultivos durante este tiempo. El alga también crecerá en agar WHM solidificado al 1%-2%.
- Para la sincronización rutinaria del ciclo celular, coloque las células de cultivos de 10 a 14 días en la oscuridad durante 2 a 6 semanas a 20-25 °C. Después de este tiempo, lave las células con WHM fresco (ver más abajo) y cultive como se describe anteriormente.
2. Marcaje de la pared celular con anticuerpos monoclonales
NOTA: P. margaritaceum está cubierto con una pared celular primaria que tiene muchos de los mismos constituyentes que se encuentran en las paredes celulares primarias de las plantas terrestres11. Muchos de los anticuerpos monoclonales (mAb) generados contra los epítopos de la pared celular de las plantas terrestres reconocen componentes de la pared celular de P. margaritaceum . Las fuentes de estos anticuerpos incluyen el Centro de Investigación de Carbohidratos Complejos de la Universidad de Georgia (ccrc@uga.edu) o Kerafast (kerafast.com). Después del marcaje de la pared celular de las células vivas con mAbs primarios específicos para los epítopos de la pared celular y anticuerpos secundarios conjugados con fluoróforos (por ejemplo, FITC, TRITC), las células pueden volver a colocarse en cultivo sin afectar la salud de la célula o la deposición de la pared celular. El marcaje fluorescente de la pared celular permanece indefinidamente, y la pared celular recién secretada se presenta como zonas oscuras (es decir, no marcadas) que pueden medirse para determinar las tasas de expansión celular y/o marcarse de nuevo con mAbs u otras sondas.
- Extraiga 5 mL de cultivo de células líquidas en crecimiento activo (10-14 días de edad) y colóquelo en un tubo de centrífuga de plástico de 15 mL. Centrifugar en una centrífuga de mesa a 1.000 x g durante 1 min.
- Vierta y deseche el sobrenadante. Vuelva a suspender el pellet en 5 mL de WHM fresco. Coloque la tapa firmemente y agite vigorosamente el tubo durante 10 segundos para volver a suspender el pellet y eliminar cualquier sustancia polimérica extracelular o EPS de la superficie de la pared celular.
- Centrifugar a 1.000 x g durante 1 min. Repita el paso 2.2 y centrifuga. Vuelva a suspender el pellet en 1 mL de WHM fresco y transfiera 200 μL de alícuotas de la suspensión celular a tubos de microcentrífuga de 1,5 mL.
- Tape los tubos y la centrífuga en una microcentrífuga a 1.000 x g. Retirar el sobrenadante y volver a suspender el pellet en 400 μL de WHM fresco.
- A la suspensión, agregue 20 μL de mAb (por ejemplo, JIM5, un mAb de rata con especificidad para el homogalacturonano metil esterificado con bajo metilo; la dilución final es 1/20 con WHM). Agite el tubo, envuélvalo en papel de aluminio y colóquelo en un rotor de laboratorio durante 90 minutos. Para obtener los mejores resultados, agite el tubo 2 veces durante el paso de incubación de 90 minutos.
- Centrifugar la suspensión celular a 1.000 x g durante 1 min. Retirar el sobrenadante y volver a suspender el pellet en 500 μL de WHM fresco. Tape el tubo y agite la suspensión de la celda durante 10 s.
- Repita el paso 2.6 2x. Después de la centrifugación, vuelva a suspender el pellet en 400 μL de WHM y 8 μL de TRITC o FITC anti-ratas de cabra (diluido 1/75 con WHM). Vértice, envuelva el tubo en papel de aluminio y colóquelo en un rotador de laboratorio durante 90 minutos.
- Repita los pasos 2.6 y 2.7. Vuelva a suspender el gránulo en 100 μL de medio de crecimiento, tape el tubo y envuélvalo en papel de aluminio hasta que esté listo para obtener imágenes.
NOTA: También se puede utilizar la incubación de las células en WHM que contienen un agente bloqueante como la leche instantánea sin clavel graso (1%) o la albúmina sérica bovina (1%) antes de la incubación en los mAbs, pero en nuestra experiencia no hace nada para etiquetar la calidad o la intensidad. El penio no expande su pared celular ni produce grandes cantidades de EPS en la oscuridad. El anticuerpo marcado permanece intacto durante al menos 3-4 días. Por lo tanto, las imágenes no tienen que realizarse de inmediato. Aquí se pueden aplicar otros mAbs, pero será necesario analizar las concentraciones. Para los estudios de cribado químico y físico, se pueden etiquetar varios ml de suspensión celular, que se mantienen en la oscuridad durante varios días y se utilizan en estudios de microplacas. Las células también se pueden marcar con el anticuerpo primario solo antes del tratamiento, seguido por el anticuerpo secundario más tarde.
3. Medición de la pared celular y las tasas de expansión celular a lo largo del tiempo
- Tome 1 mL de células marcadas con JIM5-TRITC y coloque 1 mL de WHM en un tubo de microcentrífuga de 1,5 mL. Centrifugar a 1.000 x g durante 1 min y desechar el sobrenadante. Vuelva a suspender el pellet en 250 μL de WHM y vórtice para mezclar las células.
- A cada pocillo de una placa de Petri de 12 pocillos, agregue 1 mL de WHM. En este momento, se pueden agregar inhibidores y reguladores de crecimiento específicos a cada pocillo. En este trabajo, demostramos los efectos del aumento de los niveles de calcio durante la incubación.
- Tome 30 μL de suspensión celular marcada (paso 1) y añádalo a cada pocillo de la microplaca. Agite suavemente el plato para mezclar. Sellar con film transparente.
- Cultive como se indicó anteriormente (paso 1.1) durante 24 h, 48 h o 72 h. En momentos específicos, retire 250 mL de suspensión celular de cada pocillo y colóquelo en un tubo de microcentrífuga de 1,5 μL.
- Centrifugar a 1.000 x g durante 1 min. Retire el sobrenadante. Vuelva a suspender el pellet en 50 μL de medio de crecimiento y vórtice.
- Coloque una gota de 15 μL de la suspensión de celdas en un portaobjetos de vidrio y cúbralo con un cubreobjetos de 22 x 22 (grosor 1,5). Observe las células con un microscopio de fluorescencia utilizando un filtro TRITC a 10x -20x.
- Capture imágenes de al menos 50-100 celdas. Para cada celda, mida y registre la longitud total de la celda y la longitud de la zona oscura (es decir, la nueva pared producida durante la incubación después del etiquetado).
- Determine el porcentaje promedio de nuevas paredes celulares en el cultivo. Repita el procedimiento para las células recogidas después de 48 h y 72 h para obtener información sobre la expansión de la pared celular a lo largo del tiempo.
NOTA: Los pasos 3.5-3.8 producen una suspensión celular densa que permite obtener imágenes de muchas células en un campo de visión. Esto hace que la medición manual sea mucho más cómoda. Muchos programas de software de cámara proporcionan una medición cómoda y/o automática de las dimensiones de la celda que se pueden utilizar con esta alga. También se pueden recolectar las células y etiquetarlas como se indica arriba con JIM5, pero sustituyéndolas por FITC anti-rata como anticuerpo secundario. Utilizando un microscopio de barrido láser confocal (CLSM), se pueden obtener imágenes de células con los filtros FITC y TRITC. A continuación, las señales fluorescentes se pueden asignar a diferentes pseudocolores. Esto también permite distinguir la estructura de la nueva pared celular producida durante varios tratamientos (marcada con JIM5-FITC) en comparación con las paredes celulares pre-marcadas (marcadas con JIM5-TRITC).
4. Imágenes de lapso de tiempo de la expansión de la pared celular
- Etiquete la pared celular con JIM5-TRITC como se describe anteriormente (pasos 2.1-2.8). Diluya las células 10 veces en WHM y agregue una gota de 50 μL de células en un cubreobjetos o en una placa de Petri con fondo de vidrio.
- Deje que las células se adhieran al vidrio durante 2 minutos en la oscuridad. Enjuague suavemente las células que no se hayan adherido al vidrio con 1 ml de WHM. Utilice una micropipeta y añada con cuidado WHM gota a gota al vaso.
- Agregue 30 μL de WHM encima de las celdas adheridas al vidrio. Añadir 30 μL de agarosa tibia al 4%/WHM encima de la gota de WHM/células. Deje que la agarosa se enfríe a temperatura ambiente y se solidifique.
- Para muestras en una placa de Petri, agregue suficiente WHM para cubrir completamente las células incrustadas en agarosa. En el caso de las celdas de un cubreobjetos, invierta el cubreobjetos y colóquelo suavemente sobre un portaobjetos de depresión lleno de WHM.
- Monte las células en un microscopio fluorescente. Se puede instalar iluminación externa (lámpara), o la luz del propio microscopio se puede utilizar para proporcionar energía para el crecimiento y el movimiento de las células. En un microscopio Olympus Ix83 o Ix63, una potencia de 5-6 V para la lámpara trans funciona bien. Esto puede requerir prueba y error para su sistema.
- Tome una imagen cada 10-30 minutos utilizando el conjunto de filtros TRITC para el seguimiento de la expansión de la pared celular. Agregue productos químicos/enzimas al WHM utilizado en el paso 3.8, si lo hubiera.
5. Observación de la producción de sustancias poliméricas extracelulares (EPS)
- Preparación de las células: Obtenga 5 ml de células de cultivos de 10 a 14 días y lávelas como en los pasos 1 a 4 anteriores.
- Preparación de perlas fluorescentes: A un tubo de microcentrífuga de 1,5 mL, añadir 1 gota (aproximadamente 100 μL) de perlas fluorescentes de 0,75 μm (Polysphere). Agregue 1 mL de WHM al tubo y agite vigorosamente para volver a suspender las perlas. Centrifugar a 10.000 x g durante 3 min. Retire el sobrenadante. Agregue 1 mL de WHM al pellet y agite. Centrifugar a 10.000 x g durante 3 min. Vuelva a suspender el pellet en 500 μL de WHM.
- Preparación de pocillos: Agregue 1 mL de medio WHM a los pocillos de una placa de 12 pocillos. Agregue inhibidores o reguladores de crecimiento a la concentración deseada y revuelva suavemente. Agregue 10 μL de la solución de perlas y agite suavemente la placa para mezclar las perlas. Agregue 10 μL de células lavadas a cada pocillo y agite la placa suavemente.
- Cultive la placa de células como se indicó anteriormente (1.1). Después de 24 h, coloque suavemente la placa (tenga cuidado de no mezclarla) en un microscopio de fluorescencia invertida equipado con un filtro FITC. Las cuentas se adhieren al EPS y revelan los patrones de liberación del EPS. Fotografíe las celdas a 4x, 10x o 20x.
6. Imágenes de lapso de tiempo de la formación de rastros de EPS
- Realice imágenes de lapso de tiempo en una placa de 12 pocillos (paso 3.2), como se preparó anteriormente, o en una placa de Petri individual. Siga los pasos del 1 al 4. En lugar de cultivar las células bajo luz fluorescente, las células se pueden cultivar mientras se montan en un microscopio fluorescente invertido.
- Tome imágenes de las células cada 5-10 minutos para capturar mejor el movimiento de la célula. Las perlas fluorescentes son visibles usando un conjunto de filtros FITC, pero para perlas concentradas use el canal de campo claro. Se puede instalar iluminación externa (lámpara), o la luz del propio microscopio se puede utilizar para proporcionar energía para el crecimiento y el movimiento de las células. En un microscopio Olympus Ix83, una potencia de 5-6 V para la lámpara trans funciona bien. Esto puede requerir prueba y error para su sistema.
7. Análisis estructural correlativo de la pared celular con microscopía electrónica de barrido (SEM)
NOTA: Las características alteradas de la pared celular observadas en células vivas marcadas con anticuerpos específicos de células se pueden obtener imágenes detalladas mediante SEM. Este enfoque correlativo permite obtener datos ultraestructurales que se pueden comparar con los datos de fluorescencia.
- Obtener 1 mL de una suspensión celular (control o tratada experimentalmente) en un tubo de microcentrífuga de 1,5 mL. Centrífuga a 4.000 x g durante 1 min.
- Deseche el sobrenadante. Sumerja el tubo que contiene el pellet en nitrógeno líquido o, si no está disponible, colóquelo en un congelador a -80 °C. Las células congeladas pueden almacenarse a -80 °C durante varios meses.
- En el momento del procesamiento de la pared celular, retire el tubo del congelador y deje que se descongele durante 15 minutos. Vuelva a suspender el pellet en 20 μL de WHM y coloque una gota de suspensión de celdas densas en un cubreobjetos de 45 mm x 50 mm.
- Coloque un segundo cubreobjetos en la parte superior de la gota para crear un sándwich. Colóquelo en una mesa de laboratorio y presione continuamente el sándwich para romper las células (por ejemplo, 30 s).
- Separe con cuidado los cubreobjetos de vidrio y lave las células rotas en un tubo de centrífuga de 15 ml. Centrífuga a 500 x g durante 1 min.
- Vierte el sobrenadante. El pellet debe ser blanco o ligeramente verde. Si las imágenes posteriores muestran que no se ha roto un número suficiente de células, repita el paso 3 con el gránulo aquí.
- Vuelva a suspender el pellet que contiene las paredes celulares en D-H2O y repita los pasos 7.4 y 7.5. Vuelva a suspender el pellet en 100 μL de D-H2O y colóquelo en un tubo de centrífuga de 1,5 mL.
- Obtenga un trozo de Cambridge (radio de 6 mm u 8 mm) y adhiera cinta de carbono (EMS) a su superficie. A continuación, coloque 5 μL de la suspensión de la pared celular resuspendida (paso 7) sobre la cinta de carbono. Observe el número de paredes celulares con un microscopio de disección. Si la suspensión es demasiado densa, dilúyala con D-H2O.
- Coloque el trozo en un recipiente tapado y déjelo secar (de 2 h a toda la noche). Cubra el trozo con pulverización catódica durante 50 s con un objetivo de paladio (también se pueden emplear otros objetivos). Observe las celdas a 5 kV, tamaño de punto, a 10 cm del detector de electrones secundario.
NOTA: Diluir la suspensión de la pared celular antes de depositar las gotas en la cinta de carbono limitará las paredes celulares que se depositan entre sí.
Resultados
El marcaje de la pared celular de P. margaritaceum con mAbs anti-pectina (por ejemplo, JIM5) revela una red de fibras complejadas con calcio y proyecciones que forman un patrón regular o red (Figura 1). La pectina se deposita en el centro celular o istmo, donde desplaza a la pectina más vieja hacia los polos (Figura 2). El marcaje con un anticuerpo JIM7 similar a la pectina diferente destaca la secreción inicial de pectina con alto contenido de metilesterificado en una banda estrecha en el istmo (Figura 3A, B). Otros polímeros ubicados en la pared celular, incluida la proteína arabinogalactano que está marcada con el mAb, JIM13 (Figura 4). Grandes cantidades de EPS se secretan externamente a la pared celular (Figura 5), lo que permite el deslizamiento y la formación de agregados celulares. Varias de estas técnicas de marcaje pueden integrarse en estudios de desarrollo, incluido el examen cuantitativo de la pared celular y la expansión celular (Figura 6). Del mismo modo, los estudios estructurales correlativos de la pectina mediante imágenes SEM proporcionan información ultraestructural detallada (Figura 7) que puede compararse con la microscopía basada en fluorescencia de marcaje de células vivas.
Los métodos proporcionados proporcionan una guía fundamental para emplear un alga unicelular como P. margaritaceum para varios tipos de análisis. La capacidad de realizar el inmunomarcaje de células vivas de la pared celular y de seguir los eventos de desarrollo posteriores es una ventaja particular que a menudo no se permite con los sistemas multicelulares. P. margaritaceum también ofrece una pared celular donde la pectina se encuentra en la superficie externa de la pared celular (es decir, directamente accesible para la microscopía). La obtención de imágenes y la experimentación con células en pocillos de placas de micropocillos ofrecen un medio conveniente para recopilar datos rápidamente. Finalmente, los medios para correlacionar los datos CLSM con los datos SEM proporcionan un conducto valioso para comparar eventos de células vivas con información ultraestructural.

Figura 1: Marcaje de la red de pectina con el anticuerpo monoclonal. La especificidad del anticuerpo JIM5 es homogalacturonano poco esterificado. Observe las distintas proyecciones (flechas blancas) en la superficie de la pared celular. La zona de expansión (flecha negra) es donde se agregan nuevos materiales de pared celular. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Marcaje de células JIM5 durante el desarrollo. Inicialmente, la célula se marcó con JIM5-TRITC (naranja y *) y se volvió a colocar en cultivo. Después de 24 h, las células se recolectaron y se marcaron con JIM5-FITC (verde y flecha). Esta zona representa un nuevo crecimiento. Haga clic aquí para ver una versión más grande de esta figura.
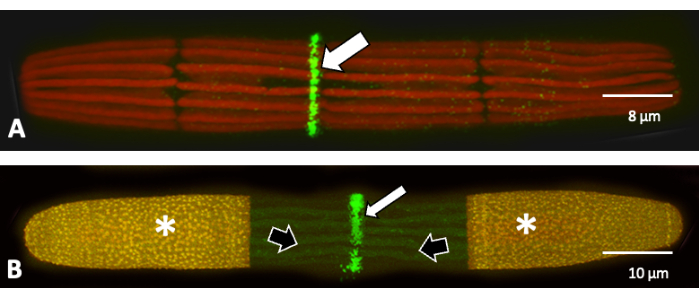
Figura 3: Etiquetado JIM7 de pectina altamente esterificada. (A) Marcaje de pectina altamente esterificada con el anticuerpo monoclonal, JIM7 (especificidad: homogalacturonano altamente esterificado) en la zona de expansión. Observe la capa estrecha (flecha blanca) en la superficie de la pared celular. (B) Etiquetado conjunto de pectina alta y baja esterificada de la pared celular durante la expansión celular. Inicialmente, la célula se marcó con JIM5-TRITC (naranja y *) y se volvió a colocar en cultivo. A las 24 h después, las células fueron recolectadas y marcadas con JIM7-FITC (verde y flecha). Las zonas oscuras entre las zonas etiquetadas representan pectina recién agregada (flechas negras). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Proteínas arabinoglactanos de la pared celular. Marcaje de las proteínas arabinogalactano (AGPs) de la superficie de la pared celular con el anticuerpo monoclonal, JIM13. Obsérvese la asociación laxa de los AGP con la pared celular (flechas). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Imágenes de rastros de deslizamiento con perlas fluorescentes. (A) Una perlas fluorescentes de 0,75 μm adheridas a la superficie de la pared celular (flechas). (B) Unión de perlas fluorescentes de rastros de EPS. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: La medición de la expansión de la pared celular se puede realizar después del etiquetado JIM5-TRITC. Las células se vuelven a colocar en cultivo y se dejan crecer durante 24 h, 48 h y 72 h. Las alícuotas de las células pueden extraerse en un período de tiempo específico y observarse con un microscopio de barrido láser confocal de fluorescencia. El porcentaje de nuevo crecimiento se determina midiendo la pared celular no marcada (línea blanca) frente a la longitud celular completa (línea amarilla). La fluorescencia roja es la autofluorescencia de la clorofila. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Estudios correlativos. (A) La red típica está hecha de una malla de fibras que a menudo terminan externamente en distintas proyecciones (flecha). (B) Cuando se trata con grandes cantidades de calcio, la red se transforma en depósitos irregulares (flechas). Célula etiquetada con JIM5. (C) Cuando las paredes celulares se tratan como en (B) y se examinan con SEM, la pectina desorganizada (flecha) se observa en detalle. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
P. margaritaceum es un organismo eficaz para dilucidar la dinámica del desarrollo de la pared celular y la secreción de MEC en plantas y algas estreptófitas. Los principales atributos incluyen un hábito unicelular y facilidad en el mantenimiento del cultivo y la manipulación experimental, una pared celular primaria con una red externa de pectina y otros polímeros distintos, facilidad en el marcaje de células vivas con mAbs dirigidos a la pared celular que se pueden seguir a tiempo para estudios posteriores de desarrollo y / o experimentales y la producción de grandes cantidades de EPS que se pueden monitorear en tiempo real utilizando perlas fluorescentes1, 2,3,6. Además, la mayoría de las técnicas de etiquetado proporcionan medios sencillos para las mediciones cuantitativas.
P. maragaritaceum es un organismo robusto que puede acomodar algunos cambios modestos en los protocolos descritos aquí. Sin embargo, es importante tener en cuenta que a) para inmunocitoquímica y manipulación experimental, utilizar células de cultivos que tengan menos de 21 días de antigüedad; b) cultivo a temperaturas no superiores a 28 °C; c) Mantener las diluciones de anticuerpos según lo prescrito. El marcaje fluorescente JIM5-TRITC durará varios días si las células se mantienen en la oscuridad. Las células marcadas con JIM7 deben obtenerse en un plazo de 24 horas. Para el marcaje de perlas fluorescentes, lo mejor es obtener imágenes de las células en 24 horas. Para experimentos específicos, especialmente aquellos que utilizan ensayos de microplacas, primero se deben probar varias concentraciones de agentes para encontrar el más activo. También es fundamental que se lleven a cabo experimentos de recuperación para asegurarse de que un agente no ha cambiado simplemente la viabilidad del cultivo celular.
Se pueden hacer fácilmente modificaciones simples a los protocolos descritos para que se ajusten a los objetivos del investigador. Hay muchos otros anticuerpos disponibles para estudiar la pared celular que aún no se han probado con P. margaritaceum. Para experimentos específicos, especialmente aquellos que utilizan el ensayo de microplacas, primero se deben probar varias concentraciones de agentes para encontrar el más activo. Las imágenes de microplaca de las células marcadas con los anticuerpos fluorescentes se pueden evaluar rápidamente mediante el cribado basado en microscopía de pocillos individuales. También es fundamental que se lleven a cabo experimentos de recuperación para asegurarse de que un agente no cambió la viabilidad del cultivo celular.
Divulgaciones
No se reporta ningún conflicto de interés.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias (NSF) (subvención MCB número 2129443 a DD).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcent. Tubes | Fisher Scientific | 01-549-740 | |
| 12 welled microplate | Fisher Scientific | 50-233-6077 | |
| 22 x 22 mm coverslips | Fisher Scientific | 12-541-016 | |
| 45x 50 cm coverslips | Brain Research | 4550-1.5D | |
| Agar | Sigma Aldrich | A9414 | |
| anti-rat FITC | Sigma Aldrich | F6258 | |
| anti-rat TRITC | Sigma Aldrich | T4280 | |
| calcium chloride | Sigma Aldrich | C4981 | |
| Cambbridge stubs | EMS | 75183-65 | |
| Fluoview CLSM | Evident | Fluoview 1200 | |
| JIM5 | Kerafast | ELD004 | |
| JIM7 | Kerafast | ELD005 | |
| Microcentrifuge | Fisher Scientific | 13-100-675 | |
| Micropipetors | BioRad | 1660499EDU | |
| Penium margaritaceum | Sammlung von Algenkulturen der Universität Göttingen - Culture Collection of Algae at Göttingen University | 2640 | |
| Polysphere kit | Polysciences | 18336 | |
| SEM | ThermoFisher | Quattro SEM | |
| sputter coater | EMS | Q150V | |
| Vortex mixer | Fisher Scientific | 02-215-414 |
Referencias
- Delmer, D., Dixon, R. A., Keegstra, K., Mohnen, D. The plant cell wall-dynamic, strong, and adaptable-is a natural shapeshifter. Plant Cell. 36 (5), 1257-1311 (2024).
- Bierenbroodspot, M. J., et al. Phylogeny and evolution of streptophyte algae. Ann Bot. 134 (3), 385-400 (2024).
- Domozych, D. S., et al. Endomembrane architecture and dynamics during secretion of the extracellular matrix of the unicellular charophyte, Penium margaritaceum. J Exp Bot. 71 (11), 3323-3339 (2020).
- Feng, X., et al. Genomes of multicellular algal sisters to land plants illuminate signaling network evolution. Nat Genet. 56 (5), 1018-1031 (2024).
- Jiao, C., et al. The Penium margaritaceum genome: Hallmarks of the origins of land plants. Cell. 181, 1097-1111 (2020).
- LoRicco, J. G., et al. The multifunctional roles of the extracellular matrix in the sessile life of the zygnematophyte Penium margaritaceum: stick, glide and cluster. Physiologie Plantarum. 176 (5), e14520 (2024).
- LoRicco, J. G., et al. Aberrant growth and expansion in Penium margaritaceum triggered by disruption of microtubules and the cell wall. J Exp Bot. erae387, (2024).
- LoRicco, J. G., et al. Chemically induced phenotype plasticity in the unicellular zygnematophyte, Penium margaritaceum. Protoplasma. 261 (6), 1233-1249 (2024).
- Davis, D. J., et al. Callose deposition is essential for the completion of cytokinesis in the unicellular alga, Penium margaritaceum. J Cell Sci. 133 (19), jcs.249599 (2020).
- Rydahl, M. G., et al. Penium margaritaceum as a model organism for cell wall analysis of expanding plant cells. Methods Mol Biol. 1242, 1-22 (2015).
- Carrillo-Carrasco, V. P., Hernández-García, J., Weijers, D. Electroporation-based delivery of proteins in Penium margaritaceum and other zygnematophycean algae. Physiol Plant. 175 (6), e14121 (2023).
- Nichols, H. W. Growth media-freshwater. Handbook Phycol Methods. , 16-17 (1973).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados