Method Article
Desarrollo de un modelo de sobremesa para evaluar la compatibilidad de los materiales de apósitos de heridas con los sistemas de tratamiento de heridas con presión negativa
En este artículo
Resumen
Este estudio presenta un modelo de sobremesa diseñado para evaluar la compatibilidad de los materiales de apósito de heridas con los sistemas de tratamiento de heridas con presión negativa mediante la evaluación de la presión y la recolección de líquidos durante 72 h bajo configuraciones de presión continua e intermitente.
Resumen
Los sistemas de tratamiento de heridas con presión negativa (NPWT) facilitan la cicatrización de heridas mediante la aplicación de presión subatmosférica en el lecho de la herida, lo que promueve la formación de tejido de granulación y reduce la inflamación. Los apósitos para heridas se pueden usar con estos sistemas para mejorar la cicatrización; sin embargo, los efectos de los apósitos en el rendimiento del dispositivo NPWT son difíciles de evaluar. El propósito de este estudio fue desarrollar un modelo análogo de carne de sobremesa para probar la compatibilidad de los materiales de los apósitos para heridas con los dispositivos NPWT. En este estudio, se evaluó un dispositivo avanzado de cuidado de heridas a base de quitosano por sus efectos sobre el rendimiento de la TPN bajo presiones terapéuticas máximas y mínimas. El objetivo era utilizar el modelo para comparar las lecturas de presión y la recolección de líquidos para muestras con y sin el dispositivo de cuidado de heridas con quitosano. El modelo de sobremesa se construyó utilizando una caja de plástico conectada a varios manómetros. Se creó un defecto circular en un trozo de panceta de cerdo, utilizado como análogo de la carne, y se insertó en la caja. El defecto se rellenó con espuma NPWT estándar o espuma combinada con el apósito para heridas. Se añadió a la caja fluido corporal simulado que contenía suero bovino, que luego se probó a presiones máximas (-200 mmHg) o mínimas (-25 mmHg) durante 72 h. La presión y la recolección de líquidos se registraron cada 12 h. El sistema NPWT mantuvo con éxito la presión durante el período de prueba de 72 h, tanto con como sin los apósitos de prueba. La adición de los apósitos para heridas no afectó la recolección de líquidos. La caja de pruebas demostró ser eficaz como modelo de sobremesa, ya que podía sellarse y mantenerse en condiciones de vacío durante el período de prueba de 72 horas. Este modelo demostró con éxito su utilidad en la evaluación de la compatibilidad de los materiales de apósitos para heridas con los sistemas NPWT.
Introducción
Existen diferentes enfoques terapéuticos para ayudar en el tratamiento y el proceso de curación de las heridas. Estos enfoques terapéuticos incluyen apósitos avanzados para heridas, factores de crecimiento, oxigenoterapia hiperbárica, sustitutos de la piel y terapia con presión negativa para heridas (TPN)1. NPWT se refiere a los sistemas de apósitos para heridas que aplican continua o intermitentemente presión subatmosférica al sistema, lo que proporciona presión negativa a la superficie de la herida. La TPN se ha convertido en una modalidad de tratamiento popular para el tratamiento de heridas agudas o crónicas2. El sistema NPWT consta de una espuma de celda abierta, un apósito adhesivo para heridas, un sistema de recolección de fluidos y una bomba de succión3. La bomba de succión, o vacío, se utiliza para mantener una presión constante sobre la herida, lo que ayuda a aumentar el flujo sanguíneo y reducir el riesgode infección. La TPN promueve la formación de tejido de granulación al eliminar el líquido de la herida y reducir la hinchazón1. Clínicamente, la cantidad de presión de succión utilizada para las heridas oscila entre -20 mmHg y -200 mmHg, pero la presión más relevante probada es de -125 mmHg5.
Los experimentos ex vivo de NPWT son un desafío debido a la falta de modelos de sobremesa adecuados para las pruebas. Los métodos actuales para probar los sistemas de NPWT incluyen simulaciones por computadora de análisis de elementos finitos (FEA), que se han utilizado para probar cómo NPWT afecta los sitios de incisión6. Otros modelos incluyen modelos de herida de sobremesa a base de agar, que se pueden utilizar para probar la absorción de líquidos7. In vivo, los modelos porcinos también se han utilizado para examinar la cicatrización de heridas8. Estos modelos tienen ventajas, como ser fáciles de simular en una computadora para predecir cómo debería sanar una herida en teoría, así como para probar el fluido que se arrastra a través de un material modelo. Las pruebas in vivo son definitivas para determinar si el sistema funciona en sujetos vivos8. Todos estos modelos también tienen desventajas. Es posible que una simulación por computadora no represente con precisión cómo se curaría una herida en la vida real. Un modelo basado en agar puede mostrar una buena recolección de líquido que se extrae a través de la herida, pero puede no representar cómo se extraería el líquido a través del tejido yel músculo. Los modelos in vivo son caros y requieren importantes recursos para completar un estudio. Además, puede ser difícil mantener a los animales semiinmóviles, por lo que puede haber desafíos con ellos tirando del sistema, lo que puede tener resultados confusos.
Se necesita un modelo de sobremesa para NPWT de modo que se puedan probar nuevos materiales para su uso con el sistema utilizando tejido real. El nuevo modelo debería ser capaz de reflejar cómo la recolección de líquido se ve afectada por el tejido y el músculo. El nuevo modelo también debería ser capaz de proporcionar lecturas de presión dentro del lecho de la herida para determinar si la herida estaba recibiendo tanta presión como la que suministraba la bomba de vacío. También se pueden probar nuevos materiales/dispositivos, como apósitos adicionales para heridas, diferentes tipos de espuma y diferentes apósitos adhesivos en la parte superior de la herida.
Ciertas heridas requieren apósitos adicionales para ayudar en el proceso de curación al reducir el riesgo de infección. Otra razón por la que se pueden requerir materiales de apósitos adicionales para heridas es para evitar el crecimiento de tejido entre la superficie del lecho de la herida y la espuma de celda abierta. Este apósito adicional reduce el riesgo de que el lecho de la herida se adhiera a la espuma de celda abierta, lo que ayuda a reducir el daño y el dolor al detener el sistema NPWT9. Estos apósitos adicionales se pueden colocar alrededor de la espuma de celda abierta para actuar como una membrana de barrera entre el lecho de la herida y la espuma. Ciertos materiales se han utilizado como interfaz entre el lecho de la herida y la espuma, como la parafina o la gasa incrustada en vaselina. La parafina ha mostrado un potencial positivo como apósito para heridas al no afectar la transferencia de presión del sistema al canal9. Sin embargo, se informó que la gasa incrustada en vaselina inhibía la recolección de líquido y, por lo tanto, no se consideró un material adicional apropiado9.
Los apósitos para heridas a base de quitosano pueden ser un buen apósito adicional para agregar durante la TPNP debido a sus efectos antimicrobianos y biocompatibilidad10,11. El quitosano es un derivado N-desacetilado de la quitina, que es un polisacárido natural que se encuentra en hongos y artrópodos12,13. El quitosano ha exhibido propiedades antibacterianas inherentes en un amplio espectro de bacterias gramnegativas y grampositivas14. Por lo tanto, las membranas de quitosano se han vuelto populares en el tratamiento de heridas porque se pueden producir fácilmente, tienen una larga vida útil y muestran efectos antimicrobianos innatos10. Estas membranas también muestran buena biocompatibilidad, biodegradación y no son tóxicas10.
En este estudio, se examinó Foundation DRS, un dispositivo avanzado para el cuidado de heridas de quitosano y glicosaminoglicanos, para determinar su biocompatibilidad con NPWT. Foundation DRS es un andamio de regeneración dérmica biodegradable fabricado para unas características de manejo y porosidad ideales para promover la invasión celular y la neoangiogénesis en las heridas. Este dispositivo es ventajoso para la curación de una variedad de lesiones y usos diferentes. Fue creado para su uso en una amplia gama de heridas, como úlceras por presión, úlceras de pie diabético, quemaduras de primer grado, heridas traumáticas, heridas dehiscentes y heridas quirúrgicas10,11. Foundation DRS es una buena opción para su uso en NPWT debido a su proceso de fabricación, que evita que el dispositivo se convierta en hidrogel cuando está mojado. Este dispositivo mantiene una estructura de poro abierto cuando se humedece, lo que debería permitir que el fluido fluya durante la aplicación de NPWT12,13.
El objetivo de este estudio fue desarrollar un modelo análogo de carne de sobremesa que pudiera utilizarse para probar la compatibilidad de los materiales de los apósitos de heridas con los dispositivos NPWT. Clínicamente, las presiones oscilan entre -80 mmHg y -125 mmHg para la mayoría de las aplicaciones de TPNP4. Para simular las condiciones de uso clínico más desfavorables, se utilizaron un ajuste de presión más alto y más bajo (-25 mmHg y -200 mmHg). Otro objetivo de este estudio fue determinar si la adición del dispositivo de cuidado de heridas de quitosano interfería con las lecturas de presión y la recolección de líquido del TPN. Las interrupciones en la recolección de líquidos o las pérdidas de presión durante la TPN podrían conducir a una mala cicatrización de las heridas y resultados clínicos. La recolección de líquido debe ser similar a la de los grupos de prueba con y sin el dispositivo de cuidado de heridas con quitosano. Las lecturas de presión también deben ser similares en todos los grupos de prueba durante 72 h. En el ámbito clínico, el apósito de la herida se cambia cada 48-72 h, por lo que cada muestra se analizó durante 72 h en este estudio3. Durante las pruebas, se deben observar las lecturas de presión para asegurarse de que no haya una caída de presión.
Protocolo
Los detalles de los reactivos y el equipo utilizado en este estudio se enumeran en la Tabla de Materiales.
1. Creación de la caja de prueba
- Consigue un recipiente de plástico de 3.2 tazas.
- Crea un agujero de 2 pulgadas de diámetro en el centro de la tapa del recipiente. Además, haga dos agujeros de 3/8 en dos esquinas de la tapa del recipiente aproximadamente a 1/2 pulgada del sello del borde. Usa una sierra de corona para crear los agujeros.
NOTA: En la Figura 1 se muestra un esquema que muestra la configuración general de las pruebas utilizando una máquina comercial NPWT conectada a una caja analógica de carne de sobremesa construida en laboratorio. Este esquema describe cómo se usa la caja para experimentos. El cuadro creado para este experimento se muestra en la Figura 2. - En el primero de los 3/8 orificios, conecte un manómetro directamente al orificio.
NOTA: Este manómetro se utilizó para controlar las caídas de presión fuera del tejido de prueba, lo que indicaría fugas en el tejido. - En el segundo orificio de 3/8, introduzca un tubo intravenoso pequeño y flexible con un diámetro exterior de menos de 3/8 a través del orificio hasta una longitud de 7 pulgadas en el lado interior de la tapa. Luego, coloque el tubo de presión en un manómetro de baja presión fuera del recipiente.
NOTA: El tubo de presión se colocó en el lecho de la herida durante la prueba.
2. Preparación de análogos de carne
- Utilice panceta de cerdo salada disponible en el mercado, conocida en este momento como tejido, para simular el tejido muscular y graso para las pruebas de NPWT.
- Cree un defecto de herida circular en la superficie del tejido con un bisturí de hoja # 21 de aproximadamente 1.5 pulgadas de ancho por 0.75 pulgadas de profundidad. Luego, fenestra el tejido a través de la grasa en cada lado con un bisturí de hoja # 21.
- Después de crear el defecto de la herida, limpie el pañuelo para eliminar el exceso de grasa de la piel y luego sumérjalo durante la noche en agua desionizada para eliminar el exceso de sal.
3. Carga de la cámara de prueba
- Llene el fondo de la cámara de prueba con espuma de celda abierta de 1.5 pulgadas de grosor. Luego, coloca el pañuelo encima de la espuma.
NOTA: Centre manualmente la muestra de tejido de modo que el defecto de la herida creado quede directamente debajo del orificio en la parte superior del párpado. - Para los grupos experimentales, agregue el dispositivo de cuidado de heridas de quitosano dentro del defecto de la herida para que el fondo y los lados del defecto queden cubiertos. Luego, llene el resto del defecto con la espuma de celda abierta.
- Inserte el tubo de presión conectado al manómetro de la cámara de prueba en la espuma de celda abierta que se utiliza para rellenar el defecto. Asegúrese de que este tubo esté colocado aproximadamente a la mitad de la superficie del defecto de la herida.
- Cubra el pañuelo con el apósito adhesivo para heridas. Luego, crea un pequeño corte en el apósito adhesivo, directamente sobre el centro de la espuma de celda abierta, rellenando el defecto de la herida.
- Pase la boquilla de vacío a través de la tapa de la cámara de prueba y colóquela encima del apósito adhesivo, donde se hizo el pequeño corte. Después de colocar la boquilla de vacío, cierre la tapa de la cámara de prueba para presionar el apósito adhesivo para heridas y la boquilla de vacío hacia abajo, lo que ayuda a crear un sello.
- Conecte el recipiente de recolección de fluidos de 500 ml a la bomba de vacío y luego conecte la boquilla de vacío al recipiente de recolección de fluidos.
4. Creación del fluido corporal simulado
- Crear un fluido corporal simulado según Marques et al.15.
- Haga el fluido corporal simulado combinando 8,035 g de NaCl, 0,355 g de NaHCO3, 0,225 g de KCl, 0,231 g de K2HPO43H2O, 0,311 g de Cl2Mg6H2O, 0,292 g de CaCl, 0,072 g de NaSO42-, 6,118 g de (HOCH2)3CNH2, y 39 mL de HCl 1 M en 960 mL de agua desionizada para llevar la solución total a 1 L.
NOTA: La composición del fluido corporal simulado se muestra en la Tabla 1. - A continuación, combine el fluido corporal simulado con suero bovino en una proporción de 3:1. Complemente la solución final con un 5% de 10x antibióticos/antimicóticos para el control microbiano. Revuelva la solución después de agregar el suero bovino y los antibióticos/antimicóticos, y luego guárdela en un refrigerador.
NOTA: La solución final se denominará solución completa. Esta solución no debe mantenerse estéril y debe prepararse fresca antes de analizar cada muestra.
5. Condiciones de ensayo
- Ajuste la configuración de la bomba de vacío para las muestras en función de las condiciones de la prueba.
NOTA: Los grupos de prueba son: Grupo 1 Control (n = 3): Espuma sola con succión continua a -200 mmHg; Grupo 2 Control (n = 3): Espuma sola con aspiración intermitente de 0 a -200 mmHg; Grupo 3 (n = 3): Dispositivo de quitosano para el cuidado de heridas bajo espuma con succión continua a -200 mmHg; Grupo 4 (n = 3): Dispositivo de quitosano para el cuidado de heridas bajo espuma con succión intermitente de 0 a -200 mmHg; Control del grupo 5 (n = 3): Espuma sola con succión continua a -25 mmHg; Grupo 6 Control (n = 3): Espuma sola con aspiración intermitente de 0 a -25 mmHg; Grupo 7 (n = 3): Dispositivo de quitosano para el cuidado de heridas bajo espuma con succión continua a -25 mmHg; Grupo 8 (n = 3): Dispositivo de quitosano para el cuidado de heridas bajo espuma con succión intermitente de 0 a -25 mmHg. - Para grupos de prueba de presión máxima, ajuste la presión a -200 mmHg. Para grupos de prueba de presión mínima, ajuste la presión a -25 mmHg. A continuación, coloque los ajustes de la bomba de vacío a presión intermitente o continua. Ejecute todas las muestras durante 72 h.
NOTA: El ajuste continuo aplica presión de forma continua durante 72 h. El ajuste intermitente aplicó presión en una relación de 5/2 (5 min de presión, seguido de 2 min sin presión) durante 72 h. Los valores máximo y mínimo se eligieron en función del rango de presión que pueden utilizar los sistemas clínicos de TPNP. Se eligió un ciclo de 72 h en función del tiempo que la TPN se utiliza clínicamente antes de realizar un cambio de vendaje3. - Durante la prueba, registre la presión en el manómetro y la cantidad de fluido en el recipiente de recolección de fluido cada 12 h durante 72 h.
- Si la cantidad de análogo de fluido corporal cae por debajo del 75% de la parte superior de la cámara de prueba, como se observa visualmente, retire el manómetro secundario y agregue una solución completa a la cámara.
NOTA: La preparación de las muestras y la configuración de las pruebas se pueden ver en la Figura 3. - Después de 72 h, apague la bomba de vacío y desconecte el recipiente de recolección de fluido de la boquilla de vacío. Retire el recipiente de recolección de fluido de la bomba de vacío.
- Retire el tejido de la cámara de prueba y retire el apósito adhesivo para heridas. Luego, saque la espuma de celda abierta y observe si el dispositivo de cuidado de heridas de quitosano aún estaba intacto. Se considera intacto si se puede quitar sin romperse, rasgarse o rasgarse; Sin embargo, los desgarros o adelgazamientos menores son aceptables si la membrana se puede eliminar por completo.
6. Análisis estadístico
- Utilice los valores de presión que se registraron cada 12 h durante el período de prueba de las tres muestras de prueba por condición de prueba para el análisis estadístico. Para el análisis estadístico, se utilizó el valor final de recolección de fluidos de las tres muestras de prueba por condición de prueba.
NOTA: Para todos los análisis estadísticos, el nivel de significación se estableció en α = 0,05. - Calcule la media y las desviaciones estándar (n = 3/grupo) en cada punto de tiempo. Antes de realizar el análisis estadístico, realice una prueba de normalidad para cada grupo utilizando la prueba de Shapiro-Wilk (p. ej., succión continua a -200 mmHg, succión continua a -25 mmHg, succión intermitente a -200 mmHg y succión intermitente a -25 mmHg) para determinar si la ANOVA o la prueba de Kruskal-Wallis son apropiadas.
- Analice los datos de los grupos experimental y de control sometidos a las mismas condiciones de prueba de presión (por ejemplo, succión continua a -200 mmHg; succión continua a -25 mmHg; succión intermitente a -200 mmHg o succión intermitente a -25 mmHg) utilizando una ANOVA de dos vías o una prueba de Kruskal Wallis utilizando el tipo de membrana y el tiempo como factores principales.
- Si se identificaron diferencias estadísticas, realice análisis post-hoc. Utilice la prueba HSD post-hoc de Tukey después del ANOVA o la prueba post-hoc de Dunn después de la prueba de Kruskal-Wallis para determinar qué grupos son diferentes.
- Utilizando los valores finales de recolección de fluidos para cada muestra en los grupos de control y experimental, realice una prueba t de dos colas asumiendo varianzas desiguales.
NOTA: La presión se analizó en cada punto de tiempo para garantizar que no hubiera una caída significativa de la presión durante el período de prueba. Si bien la recolección de líquidos se examinó en cada momento, solo se analizó en el momento final. Esto se debe a que cada tejido tenía diferentes perfiles de grasa y músculo, lo que daba como resultado diferentes tasas de recolección de líquidos, lo que hacía que la recolección general de líquidos fuera más útil para el análisis que la recolección de líquidos por puntos de tiempo.
Resultados
El objetivo del estudio fue desarrollar un modelo de sobremesa para la TPN que utilice un análogo de tejido y utilizar el modelo para investigar la compatibilidad de los materiales de los apósitos para heridas con una máquina de tratamiento de heridas con presión negativa. El modelo se utilizó para estudiar si la máquina de TPN era capaz de mantener la presión a lo largo del tiempo con la adición de un dispositivo de cuidado de heridas. El modelo también se utilizó para determinar si la presión generada y el fluido recolectado por la máquina NPWT en presencia de un dispositivo de cuidado de heridas eran diferentes en comparación con la ausencia del dispositivo.
Las presiones medias ± de desviación estándar se calcularon en cada punto de tiempo durante la prueba de 72 h para cada grupo de control y experimental. Para cada grupo, se compararon las lecturas de presión para determinar si hubo caídas de presión o aumentos de presión con el tiempo. Para las cuatro condiciones de prueba a presión máxima y mínima, y para los grupos de control y experimental, no hubo cambio estadístico en la presión durante el período de prueba de 72 h (p > 0,7). Dado que no se observó ninguna caída de presión en ningún grupo durante el período de prueba de 72 h, la adición de la membrana de quitosano no afectó el rendimiento de la bomba de vacío durante la prueba.
A la presión máxima (Figura 4), no se observó diferencia entre las lecturas de presión de los grupos de control y experimental para las condiciones de prueba continua, pero sí para la condición de prueba intermitente. Para la condición de prueba continua, el grupo experimental mostró lecturas de presión similares (-169,6 mmHg ± 1,56 mmHg) en comparación con el control (-172,9 mmHg ± 2,18 mmHg) (p = 0,27).
A la presión mínima (Figura 5), se observó una diferencia entre las lecturas de presión de los grupos de control y experimental para la condición de prueba continua, pero no hubo diferencia para la condición de prueba intermitente. Para la condición de prueba continua, el grupo experimental mostró lecturas de presión más bajas (-21,8 mmHg ± 0,7 mmHg) en comparación con el control (-27,1 mmHg ± 1,75 mmHg) (p = 6 x 10-7). Para la condición de prueba intermitente, el grupo experimental mostró lecturas de presión similares (-20,6 mmHg ± 1,45 mmHg) en comparación con el control (-23,4 mmHg + 1,83 mmHg) (p = 0,29). Se observó que la recolección de líquidos fue similar en todos los grupos (Figura 6 y Figura 7).
Hubo variación en las lecturas de presión entre las muestras de prueba. La variación se atribuyó en gran medida a la cantidad de grasa que tenía cada tejido y a lo fenestrado que estaba el tejido antes de la prueba, y no a la cámara de prueba, ya que se comprobaba rutinariamente en busca de fugas y, si se detectaba, la fuga se arreglaba antes de la prueba de la muestra.
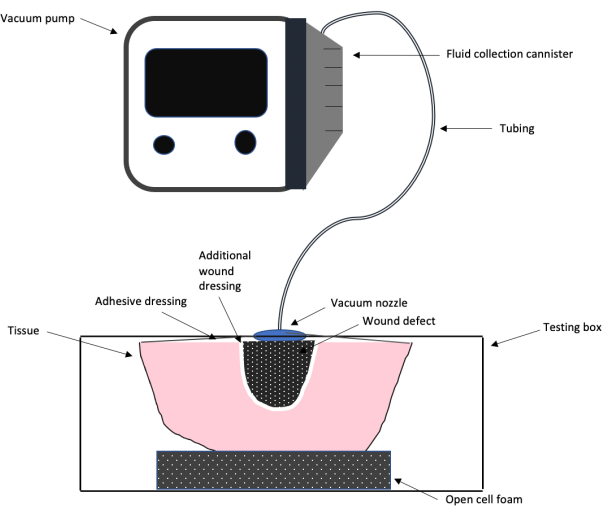
Figura 1: Esquema de la configuración de la prueba NPWT. Un esquema que muestra la configuración general del diseño de prueba del sistema de terapia de heridas con presión negativa utilizado en este trabajo, incluida la bomba de vacío, el tubo, el apósito adhesivo para heridas y la espuma, el apósito adicional para heridas y el defecto de la herida. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diseño del modelo de sobremesa NPWT. Una imagen representativa del diseño de la caja de plástico creada para el modelo de sobremesa NPWT. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Pasos en la preparación de muestras y ensamblaje de componentes para pruebas. Los pasos tomados para probar la muestra, como la preparación de la muestra, la carga de la cámara de prueba y la configuración general. La configuración de la cámara de prueba en este experimento muestra dos manómetros: uno conectado en su lado para leer la presión (izquierda) y otro que se usa como seguro y para quitar para agregar más líquido a la cámara (derecha). La cámara de prueba también muestra la ubicación del tejido relleno de espuma, el apósito para heridas y la boquilla de vacío colocada en la parte superior. Haga clic aquí para ver una versión más grande de esta figura.
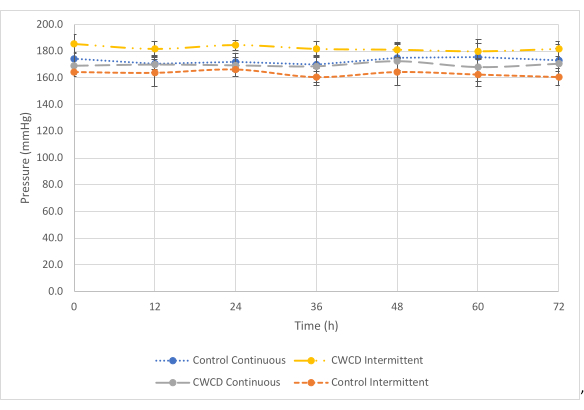
Figura 4: Comparaciones de presión máxima. La media ± las lecturas de presión de la desviación estándar para los grupos de control y experimentales (Grupos 1-4, n = 3/grupo) a presión máxima (-200 mmHg) durante 72 h. La línea azul punteada y la línea gris discontinua muestran los grupos de presión continuos. La línea naranja discontinua pequeña y las líneas amarillas discontinuas y punteadas muestran los grupos de presión intermitentes. Las lecturas de presión se promediaron de las tres muestras de cada grupo de 0 a 72 h en incrementos de 12 h. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Comparaciones de presión mínima. Las lecturas de presión media ± desviación estándar para los grupos de control y experimentales (Grupos 5-8, n = 3/grupo) a presión mínima (-25 mmHg) durante 72 h. La línea azul punteada y la línea gris discontinua muestran los grupos de presión continuos. La línea naranja discontinua pequeña y las líneas amarillas discontinuas y punteadas muestran los grupos de presión intermitentes. Las lecturas de presión se promediaron de las tres muestras de cada grupo de 0 a 72 h en incrementos de 12 h. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Imágenes representativas de la recolección final de fluidos para los Grupos 1 a 4. (A) Una imagen representativa de la recolección de fluido después de 72 h para la muestra de control del Grupo 1 bajo succión continua a presión máxima. (B) Una imagen representativa de la recolección de fluido después de 72 h para la muestra de control del Grupo 2 bajo succión intermitente a presión máxima. (C) Una imagen representativa de la recolección de fluido después de 72 h para la muestra de prueba del Grupo 3 bajo succión continua a máxima presión. (D) Una imagen representativa de la recolección de fluido después de 72 h para la muestra de prueba del Grupo 4 bajo succión intermitente a presión máxima. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Imágenes representativas de la recolección final de fluidos para los Grupos 5 a 8. (A) Una imagen representativa de la recolección de fluido después de 72 h para la muestra de control del Grupo 5 bajo succión continua a presión mínima. (B) Una imagen representativa de la recolección de fluido después de 72 h para la muestra de control del Grupo 6 bajo succión intermitente a presión mínima. (C) Una imagen representativa de la recolección de fluido después de 72 h para la muestra de prueba del grupo 7 bajo succión continua a presión mínima. (D) Una imagen representativa de la recolección de fluido después de 72 h para la muestra de prueba del Grupo 8 bajo succión intermitente a presión mínima. Haga clic aquí para ver una versión más grande de esta figura.
| Reactivo | Importe |
| Cloruro de sodio | 8.035 g |
| Bicarbonato de sodio | 0,355 g |
| Cloruro de potasio | 0,225 g |
| Fosfato de potasio dibásico trihidrato | 0,231 g |
| Cloruro de magnesio hexahidratado | 0,311 g |
| Ácido clorhídrico 1 M | 39 mL |
| Cloruro de calcio | 0,292 g |
| Sulfato de sodio | 0,072 g |
| Tris(hidroximetil) aminometano | 6.118 g |
Tabla 1: Los reactivos necesarios para preparar el fluido corporal simulado en 1 L de agua desionizada.
Discusión
Hay algunos modelos de sobremesa para NPWT, pero tienen limitaciones significativas. Loveluck et al. desarrollaron un modelo computarizado de FEA para determinar cómo el NPWT afectaba los sitios de incisión suturados, pero no tuvo en cuenta los materiales adicionales de los apósitospara heridas 6. Rycerz et al. desarrollaron modelos basados en agar para evaluar la distribución de la solución de instilación a las heridas durante la TPN7. Si bien el agar proporcionó un medio para evaluar la distribución de materiales/colorantes solubles en agua en los diferentes modelos, es un material homogéneo simple que no replica la compleja estructura heterogénea de las heridas que involucran tejidos musculares y grasos sometidos a NPWT. Además, estas pruebas se realizaron durante períodos de tiempo relativamente cortos, de hasta 3,5 h, mientras que en condiciones clínicas, es común que el vacío esté encendido durante 48-72 h antes de cambiar el apósito de la herida3. Alternativamente, in vivo, se pueden utilizar modelos porcinos, pero son caros y requieren procesos especiales de supervisión y aprobación antes de su uso7. No existen modelos de sobremesa actuales que utilicen una composición y estructuras de tejido realistas para evaluar la acumulación de líquido y las presiones dentro del lecho de la herida en relación con la bomba de vacío en diferentes condiciones experimentales.
Para abordar esta limitación, se diseñó y construyó un modelo de sobremesa para poder leer la presión durante el período de 72 horas desde el interior del defecto de la herida para ver cuánta presión se aplicaba a la herida en relación con la lectura de la bomba de vacío. Esto se logró mediante el uso del manómetro conectado al tubo de presión que pasaba por el centro de la espuma. Para reponer el líquido en el recipiente durante la prueba y no afectar el vacío, se agregó un segundo manómetro, que se podía quitar para pipetear en fluido adicional. Este segundo manómetro también actuaba como un mecanismo de seguridad porque debía leer cero, y si no lo hacía, entonces la cámara de prueba estaba siendo presurizada en lugar de la muestra de tejido, lo que invalidaría la prueba. Otra cuestión que abordó el sistema fue garantizar que hubiera suficiente sellado en la muestra; Esto se conseguía colocando un trozo de espuma debajo de la muestra para elevarla de esa manera cuando se cerraba la tapa de la cámara de pruebas, el tejido se empujaba hacia abajo lo suficiente como para cerrar la cámara sin que hubiera espacio extra.
La panceta de cerdo se utilizó para abordar la necesidad de un análogo del tejido de la herida. La panceta de cerdo, que proviene de la parte inferior del estómago del cerdo, se utilizó porque tiene capas de grasa y músculo, que imitan el complejo músculo humano y los tejidos grasos y simulan mejor las características del tejido de la herida. Además, la panceta de cerdo se obtiene fácilmente a bajo costo y solo se necesita una manipulación mínima para eliminar las sales de curado antes de su uso. Las diferentes composiciones de las muestras de tejido utilizadas podrían haber causado algunas de las diferencias de presión observadas entre los grupos. Las diferentes composiciones de grasa y tejido, o la forma en que se colocó la espuma en el tejido, pueden haber afectado la presión que la máquina pudo tirar. Clínicamente, los pacientes también exhibirán variaciones de músculo, grasa y tejido, por lo que las diferencias observadas debido a la composición de la panceta de cerdo podrían ser representativas de la variación en cómo funciona el dispositivo en los pacientes.
Este diseño de modelo de sobremesa también permite probar in vitro nuevas aplicaciones para NPWT, desde diferentes presiones hasta diferentes materiales de apósitos para heridas. También permite registrar la presión desde el interior del lecho de la herida donde se encuentra la espuma en lugar de observar solo las lecturas de presión de la bomba de vacío. Esto muestra si la presión aplicada desde la bomba se está aplicando dentro de la herida. El modelo creado en este estudio es útil porque permite registrar la recolección de fluidos y la presión sin utilizar simulaciones por computadora o pruebas in vivo . Del mismo modo, este modelo de sobremesa es ventajoso porque permite ver cómo funciona la máquina NPWT en tejidos musculares y grasos que imitan más de cerca la condición clínica en lugar de materiales a base de agar. Este modelo es más asequible que las pruebas in vivo , ya que no requiere el uso de animales vivos y se crea a partir de artículos de bajo costo.
Este modelo se utilizó para comparar las presiones generadas y el fluido recolectado por una máquina NPWT con y sin un dispositivo comercial de quitosano para el cuidado de heridas. La máquina NPWT fue capaz de mantener las presiones durante el período de 72 h en presencia o ausencia del dispositivo avanzado de cuidado de heridas con quitosano. Cuando se utilizó la máquina NPWT con o sin el dispositivo para el cuidado de heridas, no hubo diferencias o solo hubo pequeñas diferencias en las lecturas de presión entre los grupos de control (sin dispositivo para el cuidado de heridas) y prueba (con dispositivo para el cuidado de heridas) durante un período de 72 horas en las condiciones de prueba de presión máxima y mínima. Sin embargo, no hubo diferencias en la recolección de líquidos entre las membranas de control y de prueba en los grupos de tratamiento.
Ciertos pasos del protocolo fueron fundamentales para garantizar que las lecturas de presión y recolección de fluidos fueran precisas para cada muestra. Los pasos más importantes en el proceso de prueba se encontraron en el Paso 1. Para garantizar que se registraran lecturas de presión precisas, la caja de prueba creada no debía mostrar fugas; de lo contrario, los manómetros no funcionarían correctamente. Otros pasos críticos en este proceso incluyen los pasos 2.2 y 3.1. El paso 2.2 fue crucial porque el defecto de la herida tenía que ser lo suficientemente profundo como para penetrar a través de la capa final de grasa en la muestra, y el tejido debía ser fenestrado para la recolección de líquido. El paso 3.1 era crítico porque el defecto debía rellenarse con espuma de poro abierto. La espuma debe llenar todo el defecto de la herida y quedar bien ajustada; De lo contrario, no creará un sello adecuado con la aspiradora, lo que causa problemas de lectura de presión. El paso 3.4 fue crítico porque el apósito adhesivo para heridas debía cubrir toda la muestra. Si el apósito adhesivo para heridas no cubriera toda la muestra, podría haber fugas de presión dentro de la cámara de prueba.
Una limitación de este trabajo es que no existe un modelo comparable para comparar. La replicación y el uso del modelo por parte de otros ayudarán a confirmar la utilidad del modelo. Otra limitación de este modelo es la posibilidad de fugas de aire al conectar el tubo de presión al manómetro. Una mejor manera de minimizar los riesgos de fugas de aire mediante el uso de un enfoque de conexión diferente podría ser útil en estudios futuros.
Este modelo de sobremesa era necesario para NPWT para que se pudiera probar la compatibilidad del nuevo material mediante el examen de la recolección de fluidos y la generación de presión para garantizar que el apósito adicional para heridas no alterara el rendimiento del sistema NPWT. El modelo creado tiene muchas aplicaciones potenciales en NPWT. Se puede utilizar para probar diferentes materiales de apósitos para heridas y opciones locales de administración de fármacos en materiales de apósitos para heridas. Con este modelo se pueden crear y probar varios tipos de heridas, como heridas incisionales, tunelizadas o quemaduras. Para los diferentes tipos de heridas, se podría examinar la presión y la recolección de líquidos para determinar los ajustes óptimos de NPWT. Este modelo también abre otras vías para decidir cómo probar el NPWT en muestras de piel, mientras que antes, los modelos se restringían principalmente a otros materiales o pruebas simuladas. En conclusión, el modelo de sobremesa diseñado fue capaz de evaluar con éxito las presiones dentro de un lecho de herida para los apósitos de heridas para determinar si eran compatibles con el sistema NPWT.
En general, el dispositivo de cuidado de heridas de quitosano probado no pareció inhibir la presión o la recolección de líquido en el sistema NPWT para las condiciones probadas. En este trabajo, se desarrolló un modelo de sobremesa para superar las limitaciones de los modelos de sobremesa actuales, permitiendo la realización de pruebas durante largos períodos de tiempo, el uso de un análogo de tejido y la capacidad de acomodar el uso de materiales de apósitos para heridas.
Divulgaciones
Este trabajo fue apoyado por una subvención de Bionova Medical, Inc. (Germantown, TN).
Agradecimientos
Esta investigación fue posible gracias a la ayuda del Departamento de Ingeniería Biomédica de la Universidad de Memphis y Bionova Medical.
Materiales
| Name | Company | Catalog Number | Comments |
| 100x antibiotics/mycotics | Gibco | 15240062 | This is the 100X antibiotics/antimycotics used in the simulated body fluid |
| 3 M KCI ACTIV.A.C Therapy System | KCI Mdical Products | VFTR006619 | This is the vacuum pump used in the study. |
| 3 M KCI InfoV.A.C Canister w/Gel 500 mL | eSutures.com | M8275063 | These are the fluid collection canisters used in the study |
| 3 M KCI V.A.C GranuFoam Medium Dressing Kit, SensaT.R.A.C | eSutures.com | M8275052 | These are the wound dressing packs with the vacuum nozzle including the open cell foam. |
| Bovine Serum | Gibco | 16170086 | This was used to mix with the simulated body fluid and the antibiotics/antimycotics |
| Calcium Chloride | Fisher Scientific | C614-500 | This was used to create the simulated body fluid |
| Excel/Powerpoint | Microsoft Office | N/A | This was used to run the statistics and create the schematic for Figure 1 |
| Foundation DRS Solo | BioNova Medical | N/A | This is the advanced chitosan wound care device used in the study. |
| Hydrochloric Acid | Fisher Scientific | SA54-1 | This was used to create the simulated body fluid |
| Magensium Chloride | Fisher Scientific | M33-500 | This was used to create the simulated body fluid |
| Phosphate buffered saline | Thermo Scientific | J62036.K3 | This was used to dilute the 100x antibiotic/antimycotic to 10x |
| Potassium Chloride | SIGMA | P-3911 | This was used to create the simulated body fluid |
| Potassium Phosphate Dibasic | Fisher BioReagents | BP363-500 | This was used to create the simulated body fluid |
| PRM Vacuum Gauge 0 to -10 in Hg | PRM Filtration | PGCNBTY630652J10HG | Two pressure gauges are needed for the testing chamber. |
| Salted Pork Belly | Hormel Food Corporations | UPC: 0003760037988 | Salted pork belly can be bought from Kroger. It cannot be sliced. It is best to pick samples that have less fat, and more muscle. |
| Sodium Bicarbonate | SIGMA | S5761-500G | This was used to create the simulated body fluid |
| Sodium Chloride | Fisher Scientific | S640-500 | This was used to create the simulated body fluid |
| Sodium Sulfate | Fisher Scientific | BP166-100 | This was used to create the simulated body fluid |
| Tris(hydroxymethyl) aminomethane | Fisher Scientific | BP152-500 | This was used to create the simulated body fluid |
| Tupperware Brands Corp, Kissimmee , FL | Tupperware | N/A | This is the box used as the testing chamber. |
Referencias
- Liu, S., et al. Evaluation of negative-pressure wound therapy for patients with diabetic foot ulcers: Systematic review and meta-analysis. Ther Clin Risk Manag. 13, 133-142 (2017).
- Capobianco, C. M., Zgonis, T. An overview of negative pressure wound therapy for the lower extremity. Clin Podiatr Med Surg. 26 (4), 619-629 (2009).
- Venturi, M. L., Attinger, C. E., Mesbahi, A. N., Hess, C. L., Graw, K. S. Mechanisms and clinical applications of the vacuum-assisted closure (VAC) device: A review. Am J Clin Dermatol. 6 (3), 185-194 (2005).
- Ren, Y., Chang, P., Sheridan, R. L. Negative wound pressure therapy is safe and useful in pediatric burn patients. Int J Burns Trauma. 7 (2), 15-23 (2017).
- Argenta, L. C., Morykwas, M. J. Vacuum-assisted closure: A new method for wound control and treatment: Clinical experience. Ann Plast Surg. 38 (6), 563-576 (1997).
- Loveluck, J., Copeland, T., Hill, J., Hunt, A., Martin, R. Biomechanical modeling of the forces applied to closed incisions during single-use negative pressure wound therapy. Eplasty. 16, e20 (2016).
- Rycerz, A. M., Allen, D., Lessing, C. M. Science supporting negative pressure wound therapy with instillation. Int Wound J. 10 (S1), 25-31 (2013).
- Hodge, J. G., et al. Novel insights into negative pressure wound healing from an in situ porcine perspective. Wound Repair Regen. 30 (1), 64-81 (2022).
- Birke-Sorensen, H., et al. Evidence-based recommendations for negative pressure wound therapy: Treatment variables (pressure levels, wound filler and contact layer) - Steps towards an international consensus. J Plast Reconstr Aesthet Surg. 64 (Suppl. 1), S1-S16 (2011).
- Burkatovskaya, M., et al. Use of chitosan bandage to prevent fatal infections developing from highly contaminated wounds in mice. Biomaterials. 27 (22), 4157-4164 (2006).
- Noel, S. P., Courtney, H., Bumgardner, J. D., Haggard, W. O. Chitosan films: A potential local drug delivery system for antibiotics. Clin Orthop Relat Res. 466 (6), 1377-1382 (2008).
- Chen, S., Hao, Y., Cui, W., Chang, J., Zhou, Y. Biodegradable electrospun PLLA/chitosan membrane as guided tissue regeneration membrane for treating periodontitis. J Mater Sci. 48 (19), 6560-6568 (2013).
- Guo, S., et al. Enhanced effects of electrospun collagen-chitosan nanofiber membranes on guided bone regeneration. J Biomater Sci Polym Ed. 31 (2), 106-118 (2020).
- Qasim, S. B., Najeeb, S., Delaine-Smith, R. M., Rawlinson, A., Rehman, I. U. Potential of electrospun chitosan fibers as a surface layer in functionally graded GTR membrane for periodontal regeneration. Dent Mater. 33 (1), 71-83 (2017).
- Marques, M. R. C., Loebenberg, R., Almukainzi, M. Simulated biological fluids with possible application in dissolution testing. Dissolut Technol. 18 (3), 15-28 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados