Method Article
Utilización de baja tensión de oxígeno para reducir las células hematopoyéticas en cultivos de células estromales de médula ósea murina
En este artículo
Resumen
Un cultivo rutinario de células estromales de médula ósea (BMSC) conduce al aislamiento de poblaciones celulares heterogéneas, muchas de las cuales son de origen hematopoyético. Aquí, describimos un método que utiliza baja tensión de oxígeno para reducir en gran medida los contaminantes hematopoyéticos en cultivos murinos de BMSC.
Resumen
En la actualidad, sigue habiendo una falta de marcadores universalmente aceptados para aislar prospectivamente una población homogénea de células madre esqueléticas (SSC). Por esta razón, las BMSC, que apoyan la hematopoyesis y contribuyen a todas las funciones del esqueleto, continúan siendo ampliamente utilizadas para estudiar progenitores mesenquimales multipotentes (MMP) y para inferir la función de las SSC. Además, dada la amplitud de los modelos murinos transgénicos utilizados para estudiar las enfermedades musculoesqueléticas, el uso de las BMSC también sirve como una poderosa herramienta para examinar los mecanismos moleculares que regulan las MMP y las SSC. Sin embargo, los procedimientos de aislamiento comunes para las BMSC murinos dan como resultado que más del 50% de las células recuperadas sean de origen hematopoyético, lo que podría dificultar la interpretación de los datos generados durante estos estudios. En este trabajo describimos un método que utiliza baja tensión de oxígeno o hipoxia para la eliminación selectiva de células CD45+ en cultivos de BMSC. Es importante destacar que este método se puede implementar fácilmente no solo para reducir los contaminantes hemopoyéticos, sino también para aumentar el porcentaje de MMP y SSC putativas en los cultivos de BMSC.
Introducción
Al igual que las células madre hematopoyéticas (HSC), las SSC se alojan dentro del microambiente óseo; sin embargo, a diferencia de las HSCs, actualmente hay una falta de marcadores de superficie celular universalmente aceptados que puedan ser utilizados para identificar prospectivamente las SSCs 1,2,3. Sin embargo, los sistemas de cultivo in vitro y los ensayos de reconstitución in vivo demuestran que una proporción de BMSCs tienen la capacidad de soportar la hematopoyesis, así como la capacidad de diferenciarse en todas las células de los linajes mesenquimales 4,5. Por lo tanto, mientras que las BMSC representan una población muy heterogénea, una proporción de estas células tiene características de células madre genuinas, definidas por su capacidad para autorrenovarse y reconstituir todas las células de su tejido de origen. Además, a diferencia del uso de marcadores de superficie celular, las BMSC pueden aislarse rápidamente gracias a su rápida adherencia al plástico de cultivo de tejidos 6,7. Por estas razones, las BMSC se utilizan a menudo como sustitutos de las SSC5.
Si bien la adherencia preferencial al plástico de cultivo de tejidos (TC) se ha utilizado para aislar con éxito las BMSC del tejido humano, los modelos murinos presentan desafíos adicionales para este método. En particular, dado que las células hematopoyéticas murinas tienen la capacidad de adherirse tanto al plástico TC como a las BMSC, se produce una alta contaminación hematopoyética en este sistema modelo, lo que dificulta la interpretación de los datos generados con este método de aislamiento6.
En particular, las BMSC residen en el microambiente óseo, donde las tensiones de oxígeno oscilan entre el 1% y el 4%8. Sin embargo, en condiciones estándar de cultivo de tejidos, las incubadoras de cultivos celulares se mantienen a niveles de oxígeno atmosférico del 21%, lo que representa niveles suprafisiológicos. Resaltando la importancia funcional de estas diferencias, el cultivo de células de origen mesenquimal con un 21% de oxígeno se asocia con un aumento de la muerte celular 9,10. Además, recientemente hemos demostrado que las células hematológicas y las células mesenquimales responden diferencialmente a bajas tensiones de oxígeno. Específicamente, hay una disminución sustancial en el número de células hematopoyéticas CD45+ cuando los cultivos de BMSC se mantienen a bajas tensiones de oxígeno. De hecho, observamos una reducción del 90% en las células hematopoyéticas CD45+ utilizando esta técnica11.
Aquí, compartimos un protocolo que se puede implementar fácilmente para que los laboratorios reduzcan significativamente la contaminación hematopoyética y mejoren la pureza de las células mesenquimales durante el cultivo de rutina de BMSC.
Protocolo
Todos los métodos descritos, utilizando modelos murinos, se realizaron de acuerdo con los protocolos aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) (A187-19-08).
1. Disección de los huesos de las extremidades posteriores
- Eutanasia de ratones C57BL/6 machos o hembras de 10-12 semanas de edad mediante asfixia por CO2 utilizando un caudal de 2-4 L/min seguido de la confirmación de la muerte por decapitación. En este ensayo se pueden utilizar ratones hembra o macho sin que se esperen diferencias en los resultados. Rocíe la piel con etanol al 70%.
- Use pinzas quirúrgicas estériles y tijeras para hacer una pequeña incisión en la piel debajo del esternón. Use las manos para rasgar la piel alrededor de la circunferencia del cuerpo y luego tire de la piel distalmente hacia las extremidades traseras para exponer el tejido subyacente.
- Use pinzas quirúrgicas esterilizadas y tijeras para extirpar suavemente la extremidad posterior separando la cabeza femoral (bola) del acetábulo (cavidad) de la pelvis (cadera). Use pinzas estériles y un bisturí para raspar suavemente los huesos y extraer la mayor cantidad posible de tejido blando.
- Use un bisturí estéril para separar el fémur y la tibia usando una resistencia mínima para cortar los ligamentos (colateral lateral y medial, cruzado anterior y posterior, y tendón rotuliano [ligamento]) que conectan los dos huesos. Es importante destacar que, después de la separación, mantenga intactos los cóndilos tanto en el fémur distal como en la tibia proximal.
- Para los fémures distales, haga un corte entre la cabeza femoral y el tercer trocánter y un corte en la epífisis proximal a la placa de crecimiento, minimizando el daño a la placa de crecimiento.
- En el caso de las tibias proximales, haga un corte proximal al maléolo lateral y un corte distal de la meseta tibial justo proximal a la placa de crecimiento.
- Coloque los fémures y las tibias con el lado cortado hacia abajo en tubos de microcentrífuga individuales de 1,5 ml.
2. Aislamiento de BMSCs de fémures y tibias
- Coloque tubos de microcentrífuga de 1,5 ml en una centrífuga de sobremesa y haga girar a 10.000 x g a 4 °C durante 1 s.
- Use pinzas estériles para extraer cuidadosamente los huesos de los tubos de microcentrífuga, dejando un tapón rojo de médula ósea en el fondo del tubo de microcentrífuga. Si queda algo de médula en el cuerpo óseo, transfiera el hueso a un nuevo tubo, repita el giro rápido y combine los gránulos en un tubo durante la resuspensión Paso 2.3.
- Utilice una pipeta P1000 para resuspender suavemente el pellet de médula en 500 μL de medio de crecimiento, MEMa suplementado con un 20% de suero fetal bovino y 1.000 U/ml de penicilina-estreptomicina. Transfiera las células del estroma de la médula ósea a un tubo cónico de 15 mL que contenga 4,5 mL de medio de crecimiento.
3. Lisis de glóbulos rojos
- Centrifugar las celdas a 300 x g a 4 °C durante 5 min. Aspire el medio de crecimiento y vuelva a suspender suavemente el pellet en 1,5 ml de tampón de lisis de glóbulos rojos.
- Incubar a temperatura ambiente durante 75-90 s. Apagar inmediatamente con 10 mL de medio de crecimiento.
- Centrifugar las celdas a 300 x g a 4 °C durante 5 min. Aspire el medio y vuelva a suspender el pellet en 10 mL de medio de crecimiento para el recuento (consulte el paso 4).
NOTA: La pastilla de células ya no debe ser roja sino blanca, lo que indica una lisis exitosa de los glóbulos rojos. Si el pellet todavía está rojo, se puede realizar una ronda adicional de tampón de lisis de glóbulos rojos.
4. Enchapado de BMSC
- Para contar las células vivas para la siembra, retire 10 μL de suspensión celular y agregue a 10 μL de solución de azul de tripano.
- Coloque 10 μL de la mezcla de solución de celda:azul de tripano en un hemocitómetro y cuente las células viables (no azules). La mayoría de las celdas deben excluir el azul de tripano.
- Para los ensayos de colonias, coloque las células a una densidad de 60.000 células/cm2 en matraces de cultivo de tejidos T-25cm2 . Para cultivos de BMSC de alta densidad, coloque células en placas a una densidad de 130.000 células/cm2 en placas de cultivo de tejidos de 100mm2 . Utilice un volumen total de 5 mL para los matraces T-25cm 2 y un volumen total de 10 mL para los platosde 100 cm 2 .
- Incubar las células durante 3 h a 1%-2% (hipoxia) o 21% de oxígeno (normoxia) y 5% de CO2. Para el cultivo rutinario de BMSC a bajas tensiones de oxígeno, se puede utilizar una incubadora de células hipóxicas o una cámara de hipoxia. Configure cada instrumento de acuerdo con las instrucciones del fabricante para que el flujo de gas de nitrógeno y dióxido de carbono dé como resultado el rango deseado de oxígeno yCO2.
- Después de 3 h, enjuague cuidadosamente las placas 3x con 1x PBS. Para evitar alterar las células que han comenzado a adherirse, enjuague suavemente ralentizando la aspiración y el pipeteo en el costado de las placas de cultivo de tejidos.
- Después del enjuague final de 1x PBS, reemplace el PBS con 10 mL de medio de crecimiento si usa platos de100 cm2 o 5 mL de medio de crecimiento si usa matraces T-25cm2 . Después del enjuague, se deben eliminar la mayoría de las células flotantes.
5. Mantenimiento de las BMSC en condiciones hipóxicas
- Para cultivos hipóxicos, mantenga las células en una cámara de hipoxia o incubadora ajustada a 1%-2% deO2 y 5% de CO2. Para cultivos normóxicos, mantener las células al 21% deO2 y al 5% deCO2. Si utiliza una incubadora hipóxica, asegúrese de que las puertas estén mínimamente abiertas para evitar la entrada de oxígeno atmosférico (21%). Cambie los medios cada 2-3 días.
- Para los ensayos de colonias, incube las células durante 7-10 días, después de lo cual enumere las colonias o comience la diferenciación u otros ensayos deseados. En condiciones hipóxicas, se pueden anticipar entre 50 y 120 colonias, mientras que en condiciones normóxicas, se pueden anticipar entre 5 y 30 colonias.
- Para cultivos de BMSC de alta densidad, incubar las células hasta que confluyan, aproximadamente 7-10 días para cultivos hipóxicos y aproximadamente 14-21 días para cultivos normóxicos. Una vez confluentes, tripsinar las células con tripsina al 0,25% para su uso en los ensayos deseados.
- Para visualizar las células, coloque la placa de cultivo de tejidos en una plataforma, gire el objetivo de fase en la vía óptica y asegúrese de que el control deslizante de contraste de fase esté seleccionado para el objetivo correspondiente. Vea las celdas con un aumento de 100x o 200x.
Resultados
Después de 7 días de aislamiento celular, las células cultivadas al 21% de oxígeno son muy heterogéneas. Específicamente, hay una gran variación en el tamaño, con células bipolares más grandes interespaciadas con células más pequeñas que contienen múltiples protuberancias (Figura 1A). Por el contrario, las células cultivadas en condiciones hipóxicas son muy homogéneas. Las células dentro de las colonias son relativamente similares en tamaño y tienen una apariencia bipolar, que se asemeja a otras células de origen mesenquimal cultivadas en plástico de cultivo de tejidos (Figura 1B). A una densidad clonogénica de 14 días después del cultivo, las células mantenidas en cultivos normóxicos tienen aproximadamente 5-30 colonias por matraz T25cm2, que son de menor tamaño en comparación con las colonias cultivadas en condiciones hipóxicas (Figura 2A). En particular, las células cultivadas en hipoxia proliferan caracterizadas por una formación de colonias robusta, que oscila entre 50 y 120 colonias por matraz de 25cm2 (Figura 2B). Además, con un 21% de oxígeno, las células cultivadas muestran las características morfológicas distintivas de las células senescentes, que parecen grandes, planas y multinucleadas (Figura 3). Además, se puede realizar la tinción con β-galactosidasa para identificar definitivamente las células senescentes en cultivo12.
La confirmación de los tipos de células se puede lograr mediante citometría de flujo para la presencia del marcador de superficie de células hematopoyéticas, CD45+. En condiciones normóxicas, más del 50% de las células expresan el marcador de superficie celular CD45+, mientras que en condiciones hipóxicas, entre el 5% y el 10% de las células expresan este marcador, como se muestra en la Figura 4 y en un estudio previo11. Además, la confirmación de las MMPs se puede realizar mediante el examen de la expresión de marcadores como PDGFRα, SCA-1, CD73, CD90 y CD146 mediante citometría de flujo 11,13,14,15.

Figura 1: BMSC cultivado en oxígeno al 1% o al 21%. Imágenes representativas de contraste de fase de BMSC aisladas de ratones machos C57BL/6 de 12 semanas de edad y cultivadas en (A) 21% de oxígeno (normoxia) o (B) 1% de hipoxia de oxígeno durante 7 días. Las flechas blancas denotan pequeñas células hematopoyéticas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: BMSCs plateadas a densidad clonogénica en 1% y 21% de oxígeno. Imágenes representativas de contraste de fase de BMSCs aisladas de ratones machos C57BL/6 de 12 semanas de edad sembrados a una densidad clonogénica de 60.000 células/cm2. Células cultivadas en (A) 21% de oxígeno o (B) 1% de oxígeno. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Las células cultivadas en oxígeno al 21% muestran las características morfológicas de las células senescentes. Imagen de contraste de fase de BMSCs aisladas de ratones machos C57BL/6 de 12 semanas de edad y cultivadas con un 21% de oxígeno. Las flechas blancas denotan células grandes, planas y multinucleares, que son las características morfológicas de las células senescentes. Haga clic aquí para ver una versión más grande de esta figura.
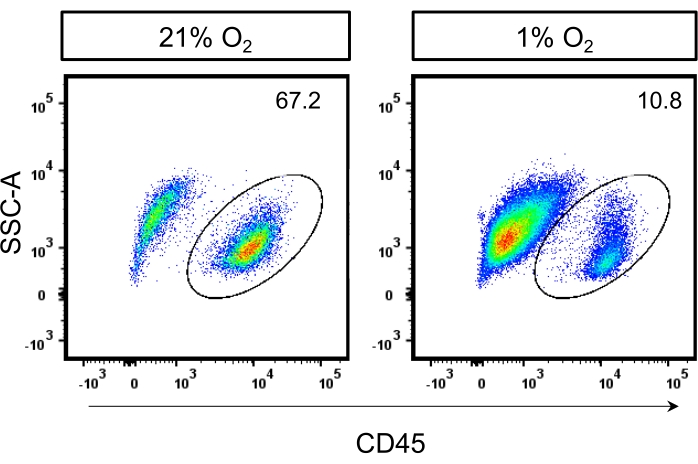
Figura 4: Análisis por citometría de flujo de células CD45+ en cultivos de BMSC. Gráficos representativos de citometría de flujo de BMSCs aisladas de ratones machos C57BL/6 de 12 semanas de edad cultivados en 21% deO2 o 1% deO2 y teñidos para CD45+. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Con base en nuestras observaciones, las BMSCs se adhieren al plástico de cultivo de tejidos antes que los macrófagos y otras células de origen hemopoyético11. Por esta razón, el enjuague de las placas 3 h después del enchapado es un paso crítico, ya que elimina las células hematopoyéticas flotantes que tienen el potencial de adherirse a puntos de tiempo posteriores. Además, estos enjuagues deben realizarse con cuidado, específicamente pipeteando los medios en el costado de la placa para evitar la interrupción de las BMSC redondeadas y sueltas que aún no han establecido la matriz y se han extendido en las placas de cultivo de tejidos. Después de tres enjuagues, se deben eliminar la mayoría de las celdas flotantes. Si bien el enjuague de los cultivos de BMSC en este punto de tiempo disminuye las células CD45+ , se requiere mantener los cultivos en hipoxia para disminuir significativamente el porcentaje de células hematopoyéticas y aumentar el porcentaje de células estromales11. Es importante destacar que si las colonias no aparecen después de 72 h, es probable que los enjuagues fueran demasiado duros y se eliminaran tanto las BMSC como las células hematopoyéticas.
Los cultivos hipóxicos deben aparecer morfológicamente homogéneos en el día 7 (Figura 1 y Figura 2), conteniendo células grandes, bipolares y fibroblásticas. Es importante destacar que este método no aísla las SSC ni una población funcionalmente homogénea de MMP, sino que aumenta la proporción de BMSC que expresan el marcador de superficie celular SSC conocido, PDGFRα, y disminuye el porcentaje de células CD45+ en los cultivos11. Es importante destacar que también se han empleado células de subcultivo, inmunodepleción y siembra a baja densidad para purificar las MMP; Sin embargo, estos métodos pueden dar lugar a fenotipos senescentes, alteración de la diferenciación y selección de clones, lo que conduce a la transformación celular 9,16,17. Si bien esta técnica disminuye el número de contaminantes hematopoyéticos, una limitación es que no aísla una población heterogénea de células, ni elimina las células hematopoyéticas CD45+. Por lo tanto, si bien se puede utilizar una purificación adicional utilizando marcadores de superficie celular expresados por SSC, el uso de bajas tensiones de oxígeno para la purificación de las poblaciones de células estromales es rápido, confiable y fácil de implementar.
La tensión de oxígeno en el microambiente óseo oscila entre el 1% y el 4% 8. Observamos que las tensiones de oxígeno del 2% o del 1% disminuyen el número de células que expresan CD45+ presentes en los cultivos de BMSC. Sin embargo, debe tenerse en cuenta para cualquier experimento posterior, como los ensayos de diferenciación, que la tensión de oxígeno deberá ser determinada por el investigador individual. Es importante tener en cuenta que el potencial de diferenciación de las BMSC puede variar en función de los niveles de oxígeno18. Esto puede deberse en parte a la sensibilidad de la vía de señalización HIF, que influye en la diferenciación de BMSC, a diferentes tensiones de oxígeno19. Por lo tanto, al purificar las MMP, este método debería mejorar la interpretación de los resultados de los experimentos que utilizan BMSC.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Departamento de Cirugía Ortopédica de la Universidad de Duke.
Materiales
| Name | Company | Catalog Number | Comments |
| 100mm2 tissue culture dishes | Corning | 353003 | |
| 1x Phosphate Buffred Saline (PBS) | Gibco | 100010-023 | |
| Bright-Line hemocytometer | Sigma-Aldrich | Z359629 | |
| C57BL/6J | The Jackson Laboratory | 664 | |
| HyClone Fetal Bovine Serum (U.S.), Characterized | GE Healthcare Life Sciences | SH30071.03 | |
| InvivO2 400 | Baker Ruskinn | https://bakerco.com | |
| MEMα, nucleosides | Gibco | 12571-063 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | |
| Red Blood Cell Lysing Buffer Hybri-Max | Sigma-Aldrich | R7757 | |
| T-25cm2 tissue culture flasks | Corning | 430168 | |
| Trypan Blue Solution | Sigma-Aldrich | T8154 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200-056 |
Referencias
- Chen, K. G., Johnson, K. R., Robey, P. G. Mouse genetic analysis of bone marrow stem cell niches: technological pitfalls, challenges, and translational considerations. Stem Cell Reports. 9 (5), 1343-1358 (2017).
- Baryawno, N., et al. A cellular taxonomy of the bone marrow stroma in homeostasis and leukemia. Cell. 177 (7), 1915-1932 (2019).
- Tikhonova, A. N., et al. The bone marrow microenvironment at single-cell resolution. Nature. 569 (7755), 222-228 (2019).
- Friedenstein, A. J., Chailakhjan, R. K., Lalykina, K. S. The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells. Cell Tissue Kinetics. 3 (4), 393-403 (1970).
- Bianco, P., Riminucci, M., Gronthos, S., Robey, P. G. Bone marrow stromal stem cells: nature, biology, and potential applications. Stem Cells. 19 (3), 180-192 (2001).
- Bearpark, A. D., Gordon, M. Y. Adhesive properties distinguish sub-populations of haemopoietic stem cells with different spleen colony-forming and marrow repopulating capacities. Bone Marrow Transplantation. 4 (6), 625-628 (1989).
- Kerk, D. K., Henry, E. A., Eaves, A. C., Eaves, C. J. Two classes of primitive pluripotent hemopoietic progenitor cells: separation by adherence. Journal Cell Physiology. 125 (1), 127-134 (1985).
- Spencer, J. A., et al. Direct measurement of local oxygen concentration in the bone marrow of live animals. Nature. 508 (7495), 269-273 (2014).
- Boregowda, S. V., et al. Atmospheric oxygen inhibits growth and differentiation of marrow-derived mouse mesenchymal stem cells via a p53-dependent mechanism: implications for long-term culture expansion. Stem Cells. 30 (5), 975-987 (2012).
- Parrinello, S., et al. Oxygen sensitivity severely limits the replicative lifespan of murine fibroblasts. Nature Cell Biology. 5 (8), 741-747 (2003).
- Guo, W., et al. Hypoxia depletes contaminating CD45(+) hematopoietic cells from murine bone marrow stromal cell (BMSC) cultures: Methods for BMSC culture purification. Stem Cell Research. 53, 102317 (2021).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. The Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Naserian, S., Shamdani, S., Arouche, N., Uzan, G. Regulatory T cell induction by mesenchymal stem cells depends on the expression of TNFR2 by T cells. Stem Cell Research and Therapy. 11 (1), 534 (2020).
- Razazian, M., et al. Differences and similarities between mesenchymal stem cell and endothelial progenitor cell immunoregulatory properties against T cells. World Journal of Stem Cells. 13 (8), 971-984 (2021).
- Ambrosi, T. H., Longaker, M. T., Chan, C. K. F. A revised perspective of skeletal stem cell biology. Frontiers in Cell and Developmental Biology. 7, 189 (2019).
- Krebsbach, P. H., Kuznetsov, S. A., Bianco, P., Robey, P. G. Bone marrow stromal cells: characterization and clinical application. Critical Reviews in Oral Biology and Medicine: An Official Publication of the American Association of Oral Biologists. 10 (2), 165-181 (1999).
- Harvey, D. M., Levine, A. J. p53 alteration is a common event in the spontaneous immortalization of primary BALB/c murine embryo fibroblasts. Genes and Development. 5 (12), 2375-2385 (1991).
- Buravkova, L. B., Andreeva, E. R., Gogvadze, V., Zhivotovsky, B. Mesenchymal stem cells and hypoxia: where are we. Mitochondrion. 19, 105-112 (2014).
- Kaelin, W. G., Ratcliffe, P. J. Oxygen sensing by metazoans: the central role of the HIF hydroxylase pathway. Molecular Cell. 30 (4), 393-402 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados