Method Article
Desarrollo de un modelo cadavérico multipuerto de clipaje de aneurisma de circulación posterior para residentes de neurocirugía y otorrinolaringología
En este artículo
Resumen
Se describe un protocolo modelo para entrenar a los estudiantes residentes de neurocirugía y otorrinolaringología en el clipaje transclival endoscópico de aneurismas de circulación posterior. Se establecen dos abordajes endoscópicos para acceder a la circulación posterior de cabezas cadavéricas inyectadas o perfundidas con silicona para el entrenamiento. Los alumnos tienen la tarea de recortar la circulación posterior en función de los escenarios clínicos.
Resumen
Los aneurismas de circulación posterior son difíciles de tratar con los métodos actuales de enrollamiento y clipaje. Para abordar las limitaciones en el entrenamiento, desarrollamos un modelo cadavérico para entrenar a los estudiantes en el clipaje endoscópico de aneurismas de circulación posterior. Se describe un abordaje transclival endoscópico (ETA) y un abordaje precaruncular transorbitario (TOPA) para acceder con éxito y sujetar aneurismas de la circulación posterior. El modelo tiene flexibilidad en el sentido de que se puede inyectar un compuesto de silicona coloreado en los vasos cadavéricos con el fin de entrenar a los estudiantes en anatomía vascular. La otra opción es que el modelo podría conectarse a una bomba de perfusión vascular, lo que permitiría la apreciación en tiempo real de un aneurisma pulsátil o roto. Este modelo cadavérico es el primero de su clase para el entrenamiento del clipaje endoscópico de aneurismas de circulación posterior. Los alumnos desarrollarán competencia en habilidades endoscópicas, disección apropiada y apreciación de la anatomía relativa mientras desarrollan un algoritmo que se puede emplear en un ámbito operativo real. En el futuro, se pueden desarrollar varios escenarios clínicos para mejorar el realismo, permitir que los estudiantes de diferentes especialidades trabajen juntos y enfatizar la importancia del trabajo en equipo y la comunicación efectiva.
Introducción
El tratamiento de los aneurismas de circulación posterior presenta desafíos únicos y tiene tasas de complicaciones más altas en comparación con otros aneurismas cerebrales1. El clipaje transcraneal de aneurismas de circulación posterior es técnicamente desafiante, con altas tasas de complicaciones y morbilidad2. El coiling endovascular y la cirugía endonasal endoscópica son alternativas seguras, ya que reducen las tasas de complicaciones y limitan la tracción en el cerebro3. Se ha demostrado que el enrollamiento endovascular tiene beneficios sobre los abordajes abiertos de la base del cráneo, y la mayoría de los centros ahora utilizan un enfoque endovascular para tratar los aneurismas cerebrales4. Sin embargo, muchos aneurismas de circulación posterior no son susceptibles de enrollarse debido a la ubicación, la tortuosidad del vaso y el tamaño del vaso2. Estudios recientes han demostrado la factibilidad del uso de abordajes endoscópicos para el clipaje de aneurismas de circulación posterior 5,6,7,8.
A pesar de que la cirugía endoscópica endonasal ha demostrado beneficios sobre los procedimientos más invasivos, varios estudios documentan una curva de aprendizaje asociada al uso de equipos endoscópicos 9,10,11. Es esta curva de aprendizaje y la falta de formación y experiencia del cirujano lo que limita el uso de esta opción de tratamiento segura y beneficiosa3. A medida que el clipaje endoscópico para aneurismas se está revelando como un curso de tratamiento factible y seguro, los residentes de neurocirugía y otorrinolaringología deberán desarrollar estos conjuntos de habilidades quirúrgicas durante su formación. Esta necesidad de habilidad técnica, combinada con una curva de aprendizaje pronunciada, requiere el desarrollo de modelos de entrenamiento realistas, ya que se necesitan varias repeticiones para reducir el tiempo en la sala de operaciones y la tasa de complicaciones en la cirugía endonasal endoscópica 9,11. En un modelo de placenta humana de clipaje de aneurisma cerebral, Belykh et al. han demostrado una mejora en el uso de aplicadores de clips de aneurisma en estudiantes después de la simulación12. Del mismo modo, se ha demostrado que el entrenamiento con modelos impresos en 3Dimension mejora las habilidades técnicas del aprendiz en el clipaje de aneurismas13. Al igual que con cualquier modelo de formación, la rentabilidad y la reproducibilidad son objetivos principales para una mayor accesibilidad. Hemos demostrado previamente la utilidad de una ETA y una TOPA en un modelo de cadáver de clipaje de aneurisma de circulación posterior, con el acceso de aproximación y la visualización afectados por la ubicación del clip14. TOPA se puede utilizar junto con abordajes endonasales endoscópicos, y ha demostrado previamente distancias de trabajo más cortas, visualización mejorada y ángulos que resultan en un mayor acceso a las estructuras 4,14. El procedimiento TOPA es un nuevo enfoque para la ligadura con clip de aneurismas, y su aplicabilidad se puede explorar más a fondo mediante simulación para el acceso tanto a tumores como a aneurismas. En este protocolo, presentamos los pasos para el desarrollo de un modelo de recorte de aneurisma de circulación posterior realista, rentable y reproducible utilizando ETA y TOPA como opciones para entrenar a los estudiantes de neurocirugía. Una ventaja de nuestro modelo es la exposición del aprendiz a la anatomía física auténtica, con la opción de incorporar un sangrado dinámico realista en el entrenamiento del clipaje de aneurismas. Este modelo se puede configurar con una anatomía estática (infundida con compuesto de silicona) o dinámica (perfundida) y es aplicable para entrenar a estudiantes de neurocirugía u otorrinolaringología en varios niveles de experiencia en la anatomía y el manejo de los aneurismas de circulación posterior.
Protocolo
En el desarrollo de este modelo, se obtuvieron tres cabezas cadavéricas a través del Programa de Donación de Cuerpos de la Universidad de Salud y Ciencia de Oregón y se manejaron según el Código de Ética aprobado por la Junta de Revisión Institucional de la Universidad de Salud y Ciencia de Oregón.
1. Preparación de la cabeza
- Obtener cabezas cadavéricas frescas. Asegure la cabeza en el fregadero, descansando sobre un bloque con el cuello hacia arriba.
- Prepare una solución de 5 L 1:100 de citrato anticoagulante dextrosa y agua tibia. Utilice la solución dentro de las 72 h.
- Insertar una cánula arterial de 5 mm en la vena yugular derecha (lateral a la carótida) y aplicar una pinza de cánula arterial alrededor del vaso. Perfundir el recipiente durante 15 min con una bomba de perfusión y una solución anticoagulante de citrato dextrosa para lavar el recipiente. Retire la cánula y repita con la vena yugular izquierda y las arterias carótidas bilateralmente. Repita con una cánula de 3 mm en las arterias vertebrales bilateralmente.
- Deje que las cabezas se asienten y se sequen durante la noche. Coloque las cabezas con la cara hacia arriba y el cuello colocado en un ángulo de 45 ° con un bloque de soporte debajo. A continuación, almacene en una cámara frigorífica a 5 °C durante la noche.
- Incruste las cabezas en 2 L de solución de embalsamamiento. Guarde las cabezas en un cubo, sumergidas en una solución fijadora de formalina al 10%.
- Utilice las cabezas preparadas con inyecciones de compuesto de silicona para entrenar con anatomía estática (paso 2) o configuración de lesión arterial y perfusión para entrenar con anatomía dinámica (paso 4).
- Para completar las inyecciones de compuesto de silicona (paso 2): complete el paso 2, luego pase al paso 3 para completar la disección.
- Para completar la configuración de la lesión arterial y la perfusión (paso 4): complete la disección del paso 3, luego pase al paso 4 para obtener instrucciones de perfusión.
2. Inyecciones de compuestos de silicona
- Prepare la solución de compuesto de silicona de acuerdo con las instrucciones del fabricante (50 μL de diluyente, 40 μL de colorante compuesto de silicona roja y 4,5 μL de agente curativo).
- Utilice la disección para identificar las arterias carótidas externas. Pinzar la arteria carótida externa derecha con un hemostático para enfocar la inyección en la vasculatura intracerebral.
- Inserte la cánula arterial en la arteria carótida interna derecha y aplique la pinza de cánula arterial alrededor del vaso. Inyecte 20 μL de solución de compuesto de silicona. Detenga la inyección cuando se observe el flujo de la solución de compuesto de silicona en la arteria carótida común izquierda.
- Pinzar las arterias carótidas comunes bilateralmente con hemostáticos.
- Inserte una cánula arterial en la arteria vertebral derecha y aplique una pinza de cánula arterial alrededor del vaso. Inyecte 10 μL de solución de compuesto de silicona. Detenga la inyección cuando se observe el flujo de solución de compuesto de silicona en la arteria vertebral izquierda.
- Pinzar las arterias vertebrales bilateralmente con hemostáticos.
- Deje que la cabeza se asiente a temperatura ambiente durante 30 minutos, luego retire suavemente todas las abrazaderas.
3. Disección de tejidos
- Coloque las cabezas con la cara hacia arriba y el cuello colocado en un ángulo de 45° con un bloque colocado debajo para visualizar las fosas nasales.
- Obtener endoscopios de 0 y 30 grados de 4 mm de diámetro y 18 cm de longitud. Conéctalo a una cámara de fibra óptica y a una fuente de luz.
- Prepare todas las cabezas con disecciones ETA y TOPA.
- ETA 14 :
NOTA: Consulte la Figura 1A para ver la representación de la disección de ETA.- Use un espéculo para mover los cornetes medios lateralmente en los lados bilaterales.
- Utilice la succión y un disector de Penfield 1 para identificar el ostium esfenoidal bilateralmente.
- Con un bisturí de 11 hojas, haga una incisión en el lado derecho del tabique nasal en la articulación del rostro esfenoidal y el vómer con el hueso. Realice la incisión 1 cm por debajo de la placa cribiforme y hasta el suelo de la cavidad nasal.
- Diseccionar el mucoperiostio del hueso utilizando un disector de Penfield 1.
- Desarticular el rostro esfenoidal del tabique nasal óseo con un disector de Penfield 1 y realizar una septectomía.
- Use un Kerrison 2 para cortar el hueso desde los ostios esfenoidales hasta el piso del seno esfenoidal bilateralmente.
- Agarre y retire la quilla con un gran rongeur pituitario para exponer el seno esfenoidal y eliminar la mucosa.
- Utilice una fresa transesfenoidal para perforar el rostro inferior restante del esfenoides al ras del suelo del seno esfenoidal.
- Identificar las impresiones óseas de las arterias carótidas cavernosas, el receso opticocarótido, la silla turca y el clivus (Figura 2); Taladre el clivus para exponer su duramadre.
- Retraiga la glándula pituitaria (que debe estar a la vista) y perfore el clivus con una fresa de diamante grueso de 5 mm.
- Retire el clinoide posterior.
- Diseccionar la duramadre de la glándula pituitaria lateral libre de la glándula pituitaria; No es necesario diseccionar la duramadre sobre la glándula pituitaria.
NOTA: Si se produce una disección inadvertida de la duramadre de la glándula pituitaria, no afectará la función del modelo. - Use un Kerrison para eliminar los fragmentos de hueso y exponer la duramadre del clival.
- Extirpar la duramadre del clival para exponer la arteria basilar, las arterias cerebelosas anteroinferiores (AICA), las arterias cerebelosas superiores (PCA) y las arterias cerebrales posteriores (PCA) (descripción general en la Figura 3, anatomía detallada en la Figura 4).
NOTA: La duramadre clival puede retraerse con un colgajo en U y estabilizarse con una sutura de seda 2-0.
- TOPA 14 :
Nota: Consulte la Figura 1B para ver la representación de la disección de TOPA.- Mueva la carúncula lateralmente con pinzas, luego use unas tijeras para hacer una incisión medial a la carúncula donde la conjuntiva se une con la piel.
- Utilice tijeras de iris para ensanchar la incisión superior e inferiormente: la incisión debe continuar detrás de las extremidades superior e inferior del tendón cantal medial; Realizar una disección roma a lo largo de la extremidad posterior del tendón cantal medial hasta la cresta lagrimal posterior.
- Utilice un disector de Penfield 1 para hacer una incisión en el periostio posterior a la cresta lagrimal.
- Levantar el periostio de la pared de la órbita medial; Continúe elevando el periostio hacia el ápice de la órbita en el plano subperióstico.
- Identificar y dividir las arterias etmoidales anterior y posterior a lo largo de la sutura fronto-etmoidal.
- Fractura de la lámina papiracea entre las arterias etmoides y por debajo de la sutura fronto-etmoidal con la presión gradual de un comodín.
- Use un rongeur pituitario para extraer hueso con el fin de exponer la silla turca, el clivus, el receso óptico contralateral y las arterias carótidas cavernosas.
4. Lesión arterial y configuración de perfusión
- Prepare la lesión arterial.
- Utilice un endoscopio para visualizar la anatomía de la circulación posterior (representación en la Figura 3 y la Figura 4).
- Seleccione la ubicación para el sangrado deseado. Para conocer las posibles ubicaciones de la hemorragia simulada de un aneurisma, consulte la figura 5. Realizar una laceración de 3 mm en la arteria deseada.
- Configuración de perfusión y sangrado
- Cánula la arteria carótida común y asegúrela con una pinza. Conecte la cánula a la bomba de perfusión.
- Prepare sangre artificial con una proporción de 3:1 de agua y sangre falsa comprada comercialmente. A continuación, añade 2 gotas de colorante rojo por cada 250 mL de agua.
NOTA: La sangre artificial preparada puede reutilizarse para múltiples simulaciones. Se preparan 3 L de sangre para cada cabeza cadavérica antes del inicio de la simulación. Esto se puede almacenar a temperatura ambiente. Agitar antes de usar. - Ponga en marcha la bomba de perfusión y mida la presión arterial media (PMA) suministrada a la cabeza del cadáver a través de un transductor de vía arterial y un monitor de signos vitales. Mantenga los MAP dentro de un rango de 65-110 mmHg para producir un sangrado realista según el escenario de simulación deseado.
5. Colocación de clips en el entrenamiento de simulación
- Utilice un clip de aneurisma y un aplicador de clips para el clipaje de vasos en este modelo (Figura 6).
- Utilice un aplicador de clips para la colocación de clips (Video 1) en los sitios de aneurisma simulados de la circulación posterior (Figura 5).
Resultados
Este modelo presenta a los alumnos múltiples sitios clínicamente relevantes para el clipaje de la circulación posterior, con opciones estáticas (inyectadas con compuesto de silicona) o dinámicas (perfundidas) para el entrenamiento. Una vez completada la disección, los investigadores pueden utilizar ETA y TOPA para proporcionar a los alumnos una mejor visualización de la circulación posterior14. En la Figura 1 se ilustra una visión general de ETA y TOPA. Para el éxito del modelo, los investigadores deben completar el protocolo de disección para exponer los sitios de corte de la circulación posterior. En la figura 2 se detalla la anatomía relevante para guiar la disección. En la Figura 3 se muestra una imagen endoscópica de la disección completa, con la anatomía relevante detallada en la Figura 4. Para los investigadores que utilizan el modelo de perfusión dinámica, se puede hacer una pequeña incisión en el sitio de clipaje deseado y las arterias carótidas se pueden perfundir a través de una bomba para producir un sangrado simulado. En la Figura 5 se detallan los posibles sitios de aplicación de clips para el entrenamiento. Durante la simulación, los alumnos tienen la tarea de aplicar clips para obtener hemostasia. En la Figura 6 se muestran imágenes representativas de la aplicación endoscópica de clips utilizando los métodos ETA y TOPA. En el vídeo 1 se muestra una representación de vídeo de la aplicación de clip en el SCA.
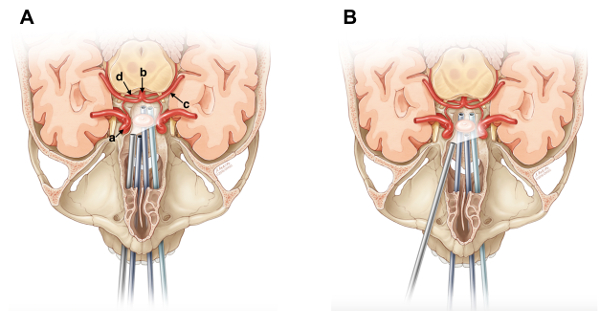
Figura 1: Representación de ETA(A) y TOPA (B). Resultados obtenidos después de completar el paso 3 del Protocolo. a) Arteria carótida cavernosa derecha. b) Arteria basilar. c) PCA izquierdo. (d) Derecho SCA. Esta figura ha sido modificada de Ciporen et al. con permiso4. Haga clic aquí para ver una versión más grande de esta figura.
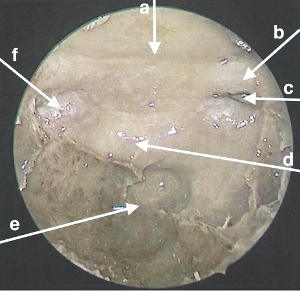
Figura 2: Vista endoscópica y anatomía de la disección de ETA. a) Tuberculum sella. b) Nervio óptico izquierdo. c) Receso opticocarotídeo izquierdo. d) Sella. e) Clivus. f) Arteria carótida cavernosa derecha. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Imagen de la exposición completa de la circulación posterior a través del endoscopio. Resultados obtenidos después de completar el paso 3 del Protocolo. (A) Vista endoscópica general. (B) Imagen en primer plano de la circulación posterior expuesta. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Vista endoscópica y anatomía de la circulación posterior expuesta. Visible después de completar el paso 3 del protocolo. a) Arteria basilar. b) Ápice basilar. c) PCA izquierdo. d) Nervio craneal izquierdo III. e) SCA izquierdo. f) AICA izquierda. g) Tronco encefálico. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Descripción de los sitios de clipaje de circulación posterior aplicables. Los clips se pueden aplicar en los lugares indicados para fines de entrenamiento: punta basilar, SCA, PCA, AICA. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Imágenes endoscópicas de la aplicación de clips de muestra utilizando los métodos ETA y TOPA. Primer panel: Aproximación de ETA a la aplicación de clips SCA. (A) Aplicación de clip en el SCA izquierdo. (B) Clip aplicado al SCA izquierdo. Segundo panel: Enfoque ETA + TOPA para la aplicación de clips SCA. (C) Aplicación de clip en el SCA izquierdo. (D) Clip aplicado al SCA izquierdo. Haga clic aquí para ver una versión más grande de esta figura.
Video 1: Aplicación de clip de aneurisma en el PCS izquierdo. Esta figura ha sido modificada de Ciporen et al. con permiso4. Haga clic aquí para ver este video. (Haga clic con el botón derecho para descargar).
Discusión
Históricamente, los aneurismas de circulación posterior han sido difíciles de cortar o enrollar, especialmente los que se originan a partir de la PCS y la AICA. Se han probado varias técnicas, como los dispositivos de embolización endovascular, los abordajes microquirúrgicos de la base del cráneo y el abordaje supraorbitario mínimamente invasivo para la aplicación de clips 15,16,17. Si bien estas técnicas son exitosas en algunos casos, la aplicabilidad generalizada es limitada debido a las marcadas diferencias en la anatomía del paciente y la ubicación posterior de los vasos de difícil acceso. Esto ha llevado a un mayor uso de la desviación del flujo en aneurismas considerados insujetables, no atrapables e inenrollables18. Si bien el desvío del flujo puede provocar cierta obliteración del aneurisma, algunos aneurismas permanecen patentes y, por lo tanto, tienen riesgo de ruptura. Presentamos, en este trabajo, el modelo combinado de abordaje ETA + TOPA, que puede ser una alternativa para el tratamiento de los aneurismas de circulación posterior.
El uso de modelos cadavéricos proporciona una multitud de ventajas para capacitar a los alumnos sobre los detalles del procedimiento y mejorar la competencia en la gestión de la vida real. En primer lugar, las variantes en la anatomía se pueden apreciar fácilmente mediante la utilización de inyecciones de compuestos de silicona. Estas inyecciones en cabezas cadavéricas permiten apreciar la anatomía realista. El compuesto de silicona proporciona una excelente visualización de la anatomía de los vasos (tanto arteriales como venosos), que se puede apreciar a medida que el aprendiz realiza el procedimiento de disección. Esta disección también permite la retroalimentación táctil auténtica que puede no estar disponible en otros modelos simulados19,20. Es importante que el aprendiz localice los vasos de forma temprana para evitar lesionarlos durante la disección. En segundo lugar, al proporcionar cabezales cadavéricos conectados a una bomba de perfusión, el alumno es capaz de desarrollar las habilidades y el algoritmo sobre cómo manejar un aneurisma pulsátil o la ruptura de un aneurisma. Este tipo de entrenamiento simulado ha sido extremadamente exitoso en la literatura cardiovascular para los aneurismas de aorta abdominal. Tomee et al. demostraron que los estudiantes que fueron capaces de desarrollar un algoritmo para la ruptura de un aneurisma durante la simulación tuvieron tasas de mortalidad significativamente más bajas en la vida real21. Del mismo modo, el entrenamiento cadavérico simulado permitirá a los alumnos tener un estándar de referencia y alternativas para solicitar aneurismas de circulación posterior difíciles de tratar.
Se han desarrollado modelos de clipaje de aneurismas de la arteria cerebral media utilizando cabezas cadavéricas y placentas humanas22. El modelo ETA + TOPA es el primer modelo humano cadavérico desarrollado para aneurismas de circulación posterior, que ofrece un entorno de aprendizaje único. Otros modelos animales, modelos de realidad virtual y modelos de base craneal se han empleado para la circulación posterior, pero son limitados por la falta de capacidad de los estudiantes para apreciar y visualizar las variantes anatómicas humanas 23,24,25. Los aneurismas de la arteria cerebral media a menudo se tratan mediante abordajes abiertos con clipaje posterior. Los aneurismas posteriores, sin embargo, son más accesibles a través de procedimientos endoscópicos. El modelo ETA + TOPA proporciona una experiencia de entrenamiento de habilidades en procedimientos neuroquirúrgicos endoscópicos. Jukes et al. demostraron que los procedimientos neuroquirúrgicos endoscópicos requieren un tipo diferente de entrenamiento y tienen factores estresantes únicos26. Al proporcionar un entorno de aprendizaje realista, los alumnos pueden reducir drásticamente la curva de aprendizaje y sentir una sensación de confianza al entrar en el ámbito operativo.
Los pasos críticos en este protocolo incluyen la inyección adecuada de silicona para permitir la visualización adecuada de la anatomía, la disección de tejidos para ver la vasculatura y generar un modelo estandarizado entre los estudiantes, y el mantenimiento del rango de presión arterial fisiológica. Estos pasos críticos, cuando se realizan correctamente, garantizan un modelo que imita más de cerca los parámetros fisiológicos y anatómicos realistas. Compruebe si hay fugas de silicona durante la inyección. Si hay fugas, retire el pinzamiento arterial, avance la cánula arterial y vuelva a sujetar el vaso. Si hay dificultad para ajustar los objetivos de presión arterial objetivo de perfusión, vuelva a poner a cero la línea arterial y repita la perfusión. Una de las limitaciones de este modelo es la consistencia del tejido, ya que el proceso de embalsamamiento puede alterar la retroalimentación táctil durante la simulación. Además, aunque el método TOPA utilizado en este modelo ha sido publicado anteriormente, aún no es un método establecido para la ligadura con clip de aneurismas y justifica un futuro entrenamiento mediante simulación.
En el futuro, se pueden proporcionar mejoras en la experiencia de simulación. Este se centrará en alterar varios escenarios clínicos con el fin de hacer que la experiencia sea realista a lo que se ve con frecuencia en el quirófano. Además, los estudiantes de neurocirugía pueden trabajar con los residentes de anestesia y otorrinolaringología en una capacitación basada en equipos. Al proporcionar escenarios de equipo, los alumnos se sentirán más cómodos trabajando con colegas de diferentes disciplinas en el quirófano. La instrucción sobre la comunicación efectiva y el trabajo en equipo se puede proporcionar a través de sesiones informativas y un instructor enfocado para brindar retroalimentación. Estas técnicas de comunicación serán aplicables a una amplia gama de procedimientos y operaciones.
Divulgaciones
Los autores no tienen nada que revelar relevante para este estudio.
Jeremy N. Ciporen, MD Consultor Spiway
Agradecimientos
Los autores no tienen agradecimientos.
Materiales
| Name | Company | Catalog Number | Comments |
| Anticoagulant citrate dextrose | Pierce Laboratories | 117037 | |
| Embalming solution | Chemisphere | ||
| 10% Formalin fixative | Chemisphere | B2915DR55 | |
| Red Microfil solution | Flow Tech | MV-130 | Silicone compound |
| Arterial cannula clamp | |||
| 5 mm Arterial cannula | Instrument Design & Mfg. Co. | ART187-2-CT | Used for jugular vein and carotid artery cannulation |
| 3 mm Arterial cannula | Instrument Design & Mfg. Co. | Used for vertebral artery cannulation | |
| Curved hemostat | Aesculap | BH139R | |
| Zero-degree endoscope (4 mm diameter, 18 cm length) | Karl Storz | H3-Z TH100 | |
| 30-degree endoscope (4 mm diameter, 18 cm length) | Karl Storz | ||
| Suction - 7 and 10 FR | V. Mueller | ||
| 11-blade surgical blade | Bard-Parker | 371111 | |
| Penfield 1 | Jarit | 285-365 | |
| Kerrison rongeur | Aesculap | FM823R, 3mm/180 mm | |
| Pituitary rongeur | Aesculap | FF806R | |
| Transsphenoidal drill | Depuy-Synthes | ||
| 5 mm coarse diamond burr drill | Depuy-Synthes | ||
| Forceps | Jarit | Carb bite I22-500 | |
| Iris scissors | Black & Black | B 66110 | |
| Perfusion Pump | Belmont Instrument Corporation, Billerica, MA, USA | Belmont Fluid Management System 2000 | |
| L-aneurysm clip | Peter Lazic Microsurgical Innovations | 45.782 | |
| Vessel clip system | Peter Lazic Microsurgical Innovations | 45.442 | |
| Dural flap clip | Weck | 523242 |
Referencias
- Spetzler, R. F., et al. The Barrow Ruptured Aneurysm Trial: 6-year results. J Neurosurg. 123 (3), 609-617 (2015).
- Somanna, S., Babu, R. A., Srinivas, D., Narasinga Rao, K. V., Vazhayil, V. Extended endoscopic endonasal transclival clipping of posterior circulation aneurysms--an alternative to the transcranial approach. Acta Neurochir (Wien). 157 (12), 2077-2085 (2015).
- Yildirim, A. E., Divanlioglu, D., Karaoglu, D., Cetinalp, N. E., Belen, A. D. Pure Endoscopic Endonasal Clipping of an Incidental Anterior Communicating Artery Aneurysm. J Craniofac Surg. 26 (4), 1378-1381 (2015).
- Ciporen, J., Lucke-Wold, B., Dogan, A., Cetas, J. S., Cameron, W. E. Dual Endoscopic Endonasal Transsphenoidal and Precaruncular Transorbital Approaches for Clipping of the Cavernous Carotid Artery: A Cadaveric Simulation. J Neurol Surg B Skull Base. 77 (6), 485-490 (2016).
- Szentirmai, O., et al. Endoscopic endonasal clip ligation of cerebral aneurysms: an anatomical feasibility study and future directions. J Neurosurg. 124 (2), 463-468 (2016).
- Drazin, D., Zhuang, L., Schievink, W. I., Mamelak, A. N. Expanded endonasal approach for the clipping of a ruptured basilar aneurysm and feeding artery to a cerebellar arteriovenous malformation. J Clin Neurosci. 19 (1), 144-148 (2012).
- Ensenat, J., et al. Endoscopic endonasal clipping of a ruptured vertebral-posterior inferior cerebellar artery aneurysm: technical case report. Neurosurgery. 69, 127-128 (2011).
- Yoshioka, H., Kinouchi, H. The Roles of Endoscope in Aneurysmal Surgery. Neurol Med Chir (Tokyo). 55 (6), 469-478 (2015).
- Shikary, T., et al. Operative Learning Curve after Transition to Endoscopic Transsphenoidal Pituitary Surgery. World Neurosurg. , (2017).
- Chi, F., et al. A learning curve of endoscopic transsphenoidal surgery for pituitary adenoma. J Craniofac Surg. 24 (6), 2064-2067 (2013).
- Qureshi, T., et al. Learning curve for the transsphenoidal endoscopic endonasal approach to pituitary tumors. Br J Neurosurg. 30 (6), 637-642 (2016).
- Belykh, E., et al. Construct Validity of an Aneurysm Clipping Model Using Human Placenta. World Neurosurg. 105, 952-960 (2017).
- Mashiko, T., et al. Training in Cerebral Aneurysm Clipping Using Self-Made 3-Dimensional Models. J Surg Educ. 74 (4), 681-689 (2017).
- Ciporen, J. N., et al. Multiportal endoscopic approaches to the central skull base: a cadaveric study. World Neurosurg. 73 (6), 705-712 (2010).
- Lan, Q., et al. Keyhole approach for clipping intracranial aneurysm: comparison of supraorbital and pterional keyhole approach. World Neurosurg. , (2017).
- Rodriguez-Hernandez, A., Walcott, B. P., Birk, H., Lawton, M. T. The Superior Cerebellar Artery Aneurysm: A Posterior Circulation Aneurysm with Favorable Microsurgical Outcomes. Neurosurgery. , (2017).
- Mazaris, P., et al. Endovascular Treatment of Complex Distal Posterior Cerebral Artery Aneurysms with the Pipeline Embolization Device. World Neurosurg. , (2017).
- Lee, S. H., et al. Surgical Flow Alteration for the Treatment of Intracranial Aneurysms That Are Unclippable, Untrappable, and Uncoilable. J Korean Neurosurg Soc. 58 (6), 518-527 (2015).
- Qian, Z. H., Feng, X., Li, Y., Tang, K. Virtual Reality Model of the Three-Dimensional Anatomy of the Cavernous Sinus Based on a Cadaveric Image and Dissection. J Craniofac Surg. , (2017).
- Shono, N., et al. Microsurgery Simulator of Cerebral Aneurysm Clipping with Interactive Cerebral Deformation Featuring a Virtual Arachnoid. Oper Neurosurg (Hagerstown). , (2017).
- Tomee, S. M., et al. The Consequences of Real Life Practice of Early Abdominal Aortic Aneurysm Repair: A Cost-Benefit Analysis. Eur J Vasc Endovasc Surg. , (2017).
- de Oliveira, M. M., et al. Learning brain aneurysm microsurgical skills in a human placenta model: predictive validity. J Neurosurg. , 1-7 (2017).
- Valentine, R., Padhye, V., Wormald, P. J. Simulation Training for Vascular Emergencies in Endoscopic Sinus and Skull Base Surgery. Otolaryngol Clin North Am. 49 (3), 877-887 (2016).
- Di Somma, A., et al. Extended endoscopic endonasal approaches for cerebral aneurysms: anatomical, virtual reality and morphometric study. Biomed Res Int. 2014, 703792 (2014).
- Oyama, K., et al. Endoscopic endonasal cranial base surgery simulation using an artificial cranial base model created by selective laser sintering. Neurosurg Rev. 38 (1), 171-178 (2015).
- Jukes, A. K., et al. Stress response and communication in surgeons undergoing training in endoscopic management of major vessel hemorrhage: a mixed methods study. Int Forum Allergy Rhinol. , (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados