Struktur von Ferrocen
Überblick
Quelle: Tamara M. Powers, Department of Chemistry, Texas A & M Universität
Im Jahr 1951 berichtete Kealy und Pauson Natur die Synthese einer neuen metallorganische Verbindung, Ferrocen. 1 in ihrem ursprünglichen Bericht Pauson schlug eine Struktur für Ferrocen in einzeln ist das Eisen gebunden (Sigma Anleihen) an ein Kohlenstoffatom jedes Cyclopentadiene Liganden (Abbildung 1, Struktur I). 1 , 2 , 3 dieses ersten Berichts führte zu weit verbreitete Interesse an die Struktur von Ferrocen und viele führende Wissenschaftler nahmen an der Strukturaufklärung von dieser interessanten neuen Molekül. Wilkinson und Woodward waren schnell zu einer alternative Schulungsbedürfnissen vorschlagen wo ist das Eisen eingeklemmt"zwischen zwei Cyclopentadiene Liganden mit gleicher Bindung an alle 10 Kohlenstoffatomen (Abbildung 1, Struktur II)". 4 hier, werden wir synthetisieren Ferrocen und entscheiden uns, basierend auf experimentellen Daten (IR und 1H NMR), die von diesen Strukturen zu beobachten ist. Darüber hinaus untersuchen wir die Elektrochemie Ferrocen durch das Sammeln von zyklischen Voltammogram. Im Zuge dieses Experiment wir die 18-Elektronen-Regel einführen und besprechen Valenz-Elektron zählen für Übergang Metall komplexe.
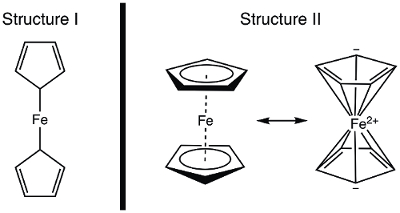
Abbildung 1. Zwei vorgeschlagenen Strukturen von Ferrocen.
Grundsätze
18-Elektronen-Regel und Total Valenz-Elektronen zählen:
Beim Zeichnen von Lewis Dot Strukturen ist es wichtig zu erinnern, die Oktett-Regel, die besagt, dass Atome von Elementen der Hauptgruppe 8 Elektronen in der äußeren Schale haben. Allerdings hält die Oktett-Regel nicht für Übergangsmetalle, die neun Valence-orbitale (1 s, drei pund fünf d -orbitale) und bietet somit Platz für weniger als 18 Elektronen. Daher gilt eine 18-Elektronen-Regel für Übergang Metall komplexe. Wie die Oktett-Regel gibt es Ausnahmen von der 18-Elektronen-Regel, aber im allgemeinen Übergang Metall komplexe mit 18 Valenzelektronen gelten als sehr stabile Verbindungen.
Es gibt zwei Methoden, die verwendet werden, um die Anzahl der insgesamt Valenz-Elektronen aus einem Übergang Metall komplexe festzustellen: das Ionische (geladenen) und die kovalente (neutral) Modell. 5 richtige Anwendung der beiden Methoden sollte die gleiche Anzahl von insgesamt Elektron hervorrufen. Beide Modelle verwenden drei Liganden Klassifizierungen genannt, x-, l- und Z-Typen. Jede Art der Liganden trägt eine unterschiedliche Anzahl von Elektronen, die Anzahl der insgesamt Elektron und ist abhängig von der Methode verwendet. X-Type Liganden enthalten anionische Gruppen wie Halogenide, Hydroxid und Alkoholate. L-Typ-Liganden enthalten Elektronenpaar Geber wie Amine und Phosphines. Zu guter Letzt sind Z-Typ Liganden Elektronenpaar-Akzeptoren; Z-Art Liganden sind daher neutral Lewis-Säuren, z. B. BR3. Wir betrachten das Molekül Co (NH3)3Cl3 , um die beiden Methoden (Abbildung 2) zu demonstrieren.

Abbildung 2. Elektron zählen beispielsweise Co (NH3)3Cl3.
Ionischen Modell:
Zunächst betrachten Sie die Anzahl der Elektronen, die durch das zentrale Atom beigetragen. Co ist in der Gruppe 9 des Periodensystems und hat somit 9 Valenzelektronen. Im Ionischen Modell muss die Oxidationsstufe des Metalls berücksichtigt werden. Da die Oxidationsstufe des Co Co (NH3)3Cl3 + 3 ist, ist die Gesamtzahl der Valenzelektronen beigetragen, indem das Metall im Ionischen Modell 6 e− (Tabelle 1). Im Ionischen Modell Spenden beide X und L-Typ-Liganden 2 e− Anzahl der gesamten Elektron, während Z-Typ Liganden keine Elektronen beitragen. Für das Beispiel Co (NH3)3Cl3gibt es zwei Liganden-Typen vorhanden. CL ist ein X-Type-Liganden und NH3 ist ein L-Typ-Liganden. Mit dem Ionischen Modell, ist die Anzahl der insgesamt Elektron 18 e− (Tabelle 1).
Tabelle 1. e− Zählung der Co (NH3)3Cl3 mithilfe der Ionischen und kovalente Modelle
| Liganden/zentralen atom | Art der Liganden | e − Beitrag
(Ionischen Modell) |
e − Beitrag
(kovalente Modell) |
| Co | n/a | 6 e− | 9 e− |
| 3 NH3 | L | 3 x (2 e−) | 3 x (2 e−) |
| 3 Cl | X | 3 x (2 e−) | 3 x (1 e−) |
| Ladung der Ionen | n/a * | − (0) | |
| Total e− Graf | 18 e− | 18 e− | |
* Die Ladung des Ions metallhaltigen gehört nicht die Anzahl der insgesamt Elektron mit dem Ionischen Modell. Die Gebühr entfällt auf in der Oxidationsstufe des Metalls (Elektronen durch das zentrale Atom beigetragen).
Kovalente Modell:
Für die kovalente Modell entspricht der e− Beitrag von Zentralatom die Gesamtzahl der Valenz e− für den neutralen Atom (in diesem Fall 9 e−). X-Type Liganden Spenden 1 e−L-Typ-Liganden Spenden 2 e−und Z-Typ Liganden Spenden 0 e−. Schließlich wenn das Molekül ionisch ist, muss die Ladung des Ions mit dem Metallzentrum aus Metall sowie die Liganden Elektronen abgezogen werden. Mit dem kovalente Modell, ist die Anzahl der insgesamt Elektron für Co (NH3)3Cl3 auch 18 e− (Tabelle 1).
Elektron Ferrocen und Ferrocenium kation zählen:
Mit dem kovalente Modell, hat Fe 8 e−. Wenn wir die Verklebung im Ferrocen betrachten, als dass ich in Struktur, die Cyclopentadiene (Cp)-Liganden sind X-Type Spender und somit jeweils 1 Elektron (Tabelle 2). Somit hätten wir 10 Valenzelektronen. Jedoch in Struktur II, spendet jeder Cp-Ring 5 Elektronen (L2X-Type Liganden), wo wir zwei Doppelbindungen haben (jeweils sind 2-Elektronen, L-Typ-Geber), und ein X-Type Spender (radikale). Dadurch werden insgesamt 18 Elektronen (Tabelle 2).
Tabelle 2.Elektron zählen für Ferrocen (Fc) und Ferrocenium (Fc+) kation mit dem kovalente Modell
| Liganden / zentrale Atom | Struktur I | Struktur II | ||||
| Art der Liganden | FC | FC+ | Art der Liganden | FC | FC+ | |
| Fe | -- | 8 e− | 8 e− | -- | 8 e− | 8 e− |
| CP | X | 2 x (1 e−) | 2 x (1 e−) | L2X | 2 x (5 e−) | 2 x (5 e−) |
| Ladung der Ionen | − (0) | − (+ 1) | Ladung der Ionen | − (0) | − (+ 1) | |
| Total Electron count | 10 e− | 9 e− | Total Electron count | 18 e− | 17 e− | |
Ferrocen erfährt bereitwillig eine 1 e− Oxidation Ferrocenium kation (Gleichung 1) ergeben.
 (1)
(1)
Betrachten wir die entstehenden Elektronen zählen für das Ferrocenium-kation Strukturen I und II. Bei einer 1 e− Oxidation wird Ferrocen Ionischen. Daher muss die Ladung (+ 1) Ferrocenium-kation die Valenzelektronen (Tabelle 2) subtrahiert werden. Subtrahieren die Ladung ergibt sich total Electron Grafen von 9 e− und 17 e− für Struktur I und II Struktur, beziehungsweise.
Die Struktur von Ferrocen ist richtig?:
Wenn Struktur ich stimmt, mit nur 10 Valenzelektronen Ferrocen wäre hochreaktive im Fe. Oxidation Ferrocenium kation Ausbeute wäre in diesem Fall recht anspruchsvoll, da Struktur von Ferrocen Elektron unzulänglich. Auf der anderen Seite II. Struktur von Ferrocen gehorcht die 18-Elektronen-Regel und steht daher im Einklang mit Ferrocen wird eine stabile Verbindung. In diesem Fall würde Oxidation von Ferrocen zum Ferrocenium kation 17 e− Spezies ergeben. Basierend auf Elektron zu zählen, kann man voraussagen, dass Ferrocen Struktur II Exponate; lassen Sie uns überlegen, wie die korrekte Struktur spektroskopisch nachweisen.
Bevor Strukturdaten veröffentlicht wurde, wurde die Struktur von Ferrocen seine magnetische und spektroskopischen Eigenschaften, sowie seine Reaktivität abgeleitet. Betrachten wir die IR-Spektren, die wir für die zwei Strukturen Vorhersagen würde. Struktur I zeigt zwei chemisch äquivalenten Protonen und sollte somit ergeben sich mehrere C-H-stretching-Modus im IR-Spektrum. Im Gegensatz dazu Struktur II zeigt eine einzige Art von C-H Bindung und sollte somit eine einzelne C-H-Verbindung anzeigen. NMR-Spektroskopie bereitwillig verfügbar gewesen in den 1950er Jahren, dies würde auch einen Anhaltspunkt bieten: zwei Resonanzen im Spektrum 1H Struktur ich, und eine Resonanz für Struktur II vorhergesagt werden würde. In diesem Experiment werden wir synthetisieren Ferrocen und spektroskopische Daten verwenden, um seine Struktur belegen.
Verfahren
1. knacken Cyclopentadiene Dimer (Abbildung 3)
Cyclopentadiene erfährt eine Diels-Alder-Reaktion mit sich selbst, Dicyclopentadiene zu geben. Diese Reaktion ist reversibel, so dass Risse mit La Châtelier Prinzip, um die umgekehrte Reaktion zu fahren, durch Destillation der Cyclopentadiene Monomer (b.p. 42 ° C) Weg von der Dicyclopentadiene Dimer (b.p. 170 ° C) erreicht ist. Die Dimerisierung Reaktion ist langsam, wenn die Cyclopentadiene ist kalt gehalten, aber es frisch zubereitet werden, muss um erfolgreich Ferrocen zu synthetisieren.
- Ein 25-mL Rundboden Fläschchen fügen Sie hinzu, rühren Bar und 10 mL Dicyclopentadiene Dimer.
Achtung: Achten Sie darauf, nur Dicyclopentadiene und Cyclopentadiene in einer Dampfhaube verwenden, weil sie beide Gestank Chemikalien sind. - Eine fraktionierte Destillation Apparat (siehe "Fraktionierte Destillation" Modul der Serie Essentials of Organic Chemistry ) Rundboden Kolben beimessen, und in einem Ölbad auf eine mitreißende heiße Platte legen. Achten Sie darauf, die sammeln von Flaschen im Eisbad haben. Klemmen Sie das Gerät im Ort.
- Die Heizplatte auf 160 ° C und rühren Sie vorsichtig die Lösung.
- Fraktionierte destillieren ~ 5 mL der Cp-Monomer aus der Dimer (39-42 ° C).

Abbildung 3. Knacken des Dicyclopentadiene.
2. Synthese von Ferrocen (Abbildung 4)
- Eine 100-mL-Schlenk-Kolben, hinzufügen, rühren Bar und 15 g fein gemahlen KOH.
Achtung: KOH ist sehr ätzend und hygroskopisch! Die KOH sollte in einem gut gelüfteten Abzug gemahlen und sofort nach der Zubereitung verwendet. - 30 mL 1,2-Dimethoxyethane in den Kolben unter Rühren zugeben.
- Verbinden Sie den Kolben mit Stickstoff und legen ein Gummiseptum über den Hals des Kolbens.
- Hinzugeben Sie unter Rühren unter Stickstoff 2,75 mL Cyclopentadiene per Spritze. Zulassen, dass dies für mindestens 10 Minuten vor der Zugabe des Eisens rühren.
- Während die Reaktion rührt, Hinzufügen einer Stir Bar, 3,25 g Boden FeCl2·4H2O und 12,5 mL DMSO in eine separate 50 mL Schlenk-Kolben. Legen Sie eine Septum am Hals und unter Stickstoff rühren Sie, bis alle des Eisens hat sich aufgelöst.
- Kanüle die Eisen-Lösung zum Übertragen der Cyclopentadienyl-Lösung unter Stickstoff tropfenweise im Laufe von 30 min Lesen Sie für eine detailliertere Verfahren bitte die "Synthese von ein Ti(III) Metallocen-Katalysatoren Verwendung Schlenk Linie Technik" Video in dieser Serie Anorganische Chemie .
- Sobald die Zugabe abgeschlossen ist, für eine zusätzliche 30 min rühren.
- Unterdessen in ein Becherglas kühlen Sie 45 mL 6 M HCl durch Zugabe von Eiswürfeln (50 g) direkt an die Lösung ab.
- Sobald die Reaktion abgeschlossen ist, Gießen Sie die Mischung auf die Gülle und für ein paar Minuten rühren. Orange Kristalle bilden sollten.
- Sammle die Kristalle auf einen Büchner-Trichter (ausgestattet mit Filterpapier), und den Niederschlag mit Wasser zu waschen.
- Lassen Sie die Feststoffe an der Luft trocknen.

Abbildung 4. Synthese von Ferrocen.
3. Reinigung von Ferrocen. Reinigen Sie das Produkt durch Sublimation (eine detailliertere Verfahren finden Sie das Video "Reinigung von Ferrocen durch Sublimation").
4. Charakterisierung von Ferrocen
- Vorbereiten und ein 1H-NMR-Spektrum von Ferrocen zu sammeln.
- Eine IR-Spektrum von Ferrocen zu sammeln.
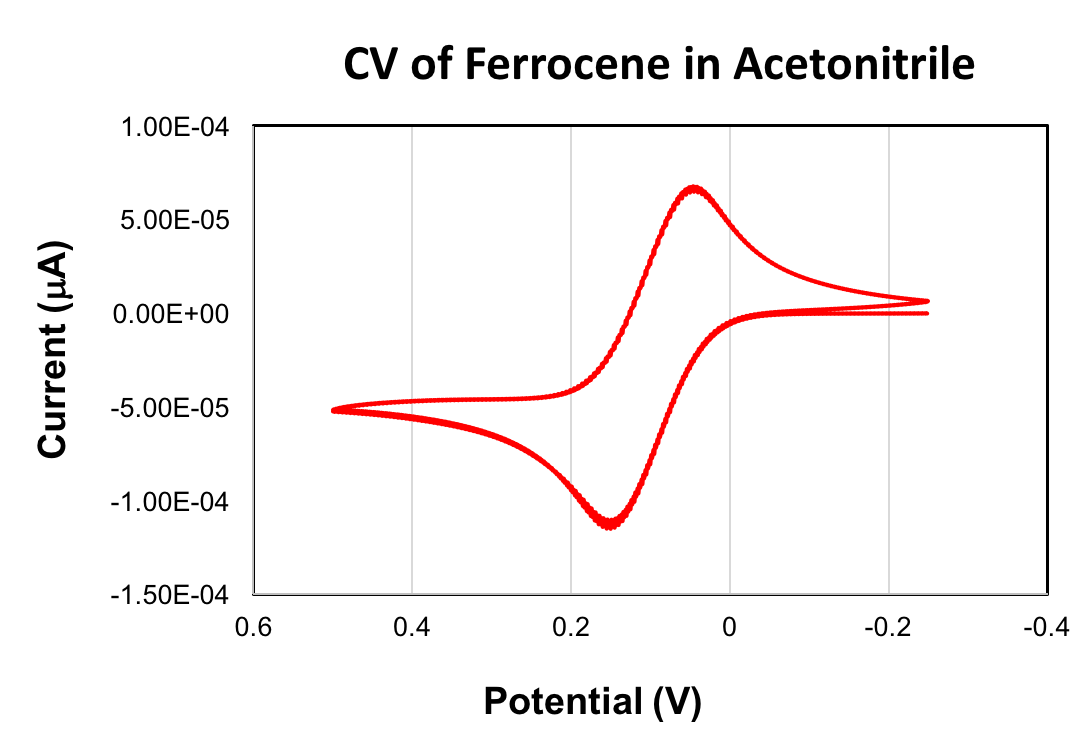
- Eine zyklische Voltammogram von Ferrocen zu sammeln (siehe die "Zyklische Voltammetrie" Video der Serie Essentials of Analytical Chemistry ).
Ergebnisse
Ferrocen Charakterisierung:
1 H-NMR (Chloroform -d, 300 MHz, δ, ppm): 4.15 (s).
Die 1H-NMR-Spektrum von Ferrocen zeigt deutlich eine einzelne Resonanz, Struktur II entsprechen.
Ein Lebenslauf des Ferrocen wird unten gegeben. Die E1/2 Wert für die Oxidation von Ferrocen + 90 war mV (Acetonitril, Scan-Rate 100 mV/s, 0,1 M (Bu4N) PF6, glassy Carbon Arbeitselektrode). Das Ferrocen/Ferrocenium Redox-paar wird häufig als Referenz in zyklischer Voltammetrie verwendet. Wenn als Referenz verwendet, ist der E-1/2 -Wert des Ferrocen 0 V festgelegt.
Anwendung und Zusammenfassung
In diesem Video diskutierten wir Ferrocen und die Rolle, die sie bei der Entwicklung der organometallischen Chemie gespielt. Ferrocen wurde synthetisiert und charakterisiert durch 1H NMR und IR-Spektroskopie. Beide Spektren stehen im Einklang mit den 18 e− Struktur II, wo das Eisen "zwischen zwei Cyclopentadiene Liganden mit gleicher Bindung an alle 10 Kohlenstoffatomen (Abbildung 1, Struktur II) eingeklemmt ist". Oxidation von Ferrocen zum Ferrocenium kation wurde elektrochemisch beobachtet.
Im Jahr 1973, nach der strukturellen Charakterisierung von Ferrocen Wilkinson war einer von zwei Chemikern den Nobelpreis für Chemie "für [seine] Pionierarbeit... auf die Chemie der metallorganischen so genannten Sandwich-komplexe". 6 sein Werk stark beeinflusst und die aufstrebende Gebiet der organometallischen Chemie erweitert. Während die erste metallorganische Verbindung im Jahre 1849 vorbereitet wurde, war es nur in den 1950er Jahren, die bedeutenden Fortschritte gemacht wurden, um zu verstehen, wie Metalle, Kohlenstoff-Atome binden können. Heute, der organometallischen Chemie oder Chemie von Verbindungen, die Metall-Kohlenstoff-Bindungen zu bilden ist zentral für viele Anwendungen. Dazu gehören: Energie, farbstoffsensibilisierten Solarzellen, Katalyse, Polymerisation, Arzneimittelforschung und Synthese, bioanorganische Systeme und organischen Leuchtdioden (OLEDs). 7
Ferrocen selbst spielt auch eine aktive Rolle auf dem Gebiet der metallorganischen Chemie. Ferrocen nimmt bereitwillig elektrophiler aromatischer Ersatz; in der Tat ist es 100.000 Mal reaktiver als Benzol in diesen Reaktionen. Ferrocen findet breite Anwendung als eine strukturelle Komponente zweizähnigen Liganden in metallorganische Katalyse. 1, 1'-Bis (Diphenylphosphino) Ferrocen (Dppf) ist beispielsweise ein chelatisierenden Liganden in der homogenen Katalyse verwendet. Die Liganden Dppf bilden, 1St, 2Ndund 3rd Zeile Übergangsmetallen wie Ni, Pd und PT [1,1'-Bis(diphenylphosphino) ferrocene]palladium(II) Paraquatdichlorid ist ein Beispiel für Katalysator Palladium Kreuz-Kupplung für die C-C und C-Heteroatom-Bindung Bildung (Abbildung 5). 8 in dem video "MO Theorie der Übergangsmetall komplexe", werden wir zwei Metallkomplexe mit Dppf synthetisieren.

Abbildung 5. [1,1'-Bis(diphenylphosphino) ferrocene]palladium(II) Paraquatdichlorid ist ein Kreuz-Kupplung Katalysator für C-C- und C-X-Band-Formation.
Referenzen
1. Kealy, T. J., Pauson, P. L. A New Type of Organo-Iron Compound. Nature. 168 (4285), 1039-1040 (1951).
2. Pauson, P. L. Ferrocene—how it all began. J Organomet Chem. 637, 3-6 (2001).
3. Seeman, J. I., Cantrill, S. Wrong but seminal. Nat Chem. 8 (3), 193-200 (2016).
4. Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. The Structure of Iron Bis-cyclopentadienyl. 74, 2125-2126 (1952).
5. Green, M. L. H., Parkin, G. Application of the Covalent Bond Classification Method for the Teaching of Inorganic Chemistry. J Chem Educ. 91 (6), 807-816 (2014).
6. Press Release. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1973/press.html.
7. Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 6th ed. John Wiley & Sons. Hoboken. 2014.
8. Gildner, P. G., Colacot, T. J. Reactions of the 21st Century: Two Decades of Innovative Catalyst Design for Palladium-Catalyzed Cross-Couplings. Organometallics. 34, 5497-5508 (2015).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Struktur von Ferrocen
Inorganic Chemistry
79.4K Ansichten

Synthese eines Ti(III)-Metallocen-Katalysators mittels Schlenk-Technik
Inorganic Chemistry
31.6K Ansichten

Handschuhbox und Verunreinigungssensoren
Inorganic Chemistry
18.6K Ansichten

Reinigung von Ferrocen durch Sublimation
Inorganic Chemistry
54.5K Ansichten

Die Evans-Methode
Inorganic Chemistry
68.4K Ansichten

Einkristall- und Pulverröntgendiffraktometrie
Inorganic Chemistry
104.4K Ansichten

Elektronenparamagnetische Rezonanzspektroskopie (EPR-Spektroskopie)
Inorganic Chemistry
25.4K Ansichten

Mößbauerspektroskopie
Inorganic Chemistry
22.0K Ansichten

Lewis-Säure-Base-Wechselwirkungen in Ph3P-BH3
Inorganic Chemistry
38.8K Ansichten

Anwendung der Gruppentheorie auf die IR-Spektroskopie
Inorganic Chemistry
45.2K Ansichten

Molekülorbital (MO)-Theorie
Inorganic Chemistry
35.3K Ansichten

Vierfach-metallgeklebte Schaufelräder
Inorganic Chemistry
15.3K Ansichten

Farbstoffsensibilisierte Solarzellen
Inorganic Chemistry
15.8K Ansichten

Synthese eines Sauerstoff-transportierenden Cobalt(II) - Komplex
Inorganic Chemistry
51.6K Ansichten

Photochemische Initiierung von radikalischen Polymerisationsreaktionen
Inorganic Chemistry
16.7K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten