Method Article
Isolierung von lebenden myeloischen und epithelialen Zellpopulationen aus der Lunge der Maus
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Isolierung lebender immuner und nicht-immuner Populationen aus der Lunge von Mäusen in einem stabilen Zustand und nach einer Influenzainfektion. Es bietet auch Gating-Strategien zur Identifizierung von epithelialen und myeloischen Zelluntergruppen.
Zusammenfassung
Die Lunge ist ständig Krankheitserregern und anderen schädlichen Umweltreizen ausgesetzt, was sie anfällig für Schäden, Funktionsstörungen und die Entwicklung von Krankheiten macht. Studien mit Mausmodellen für Atemwegsinfektionen, Allergien, Fibrose und Krebs waren entscheidend, um die Mechanismen des Krankheitsverlaufs aufzudecken und therapeutische Ziele zu identifizieren. Die meisten Studien, die sich auf die Lunge von Mäusen konzentrieren, priorisieren jedoch die Isolierung von Immunzellen oder Epithelzellen und nicht beide Populationen gleichzeitig. Hier beschreiben wir ein Verfahren zur Herstellung einer umfassenden Einzelzellsuspension sowohl von Immun- als auch von Nicht-Immunpopulationen, die für die Durchflusszytometrie und die fluoreszenzaktivierte Zellsortierung geeignet ist. Zu diesen Populationen gehören Epithelzellen, Endothelzellen, Fibroblasten und eine Vielzahl von myeloischen Zelluntergruppen. Dieses Protokoll beinhaltet eine bronchoalveoläre Lavage und eine anschließende Inflation der Lunge mit Dispase. Die Lungen werden dann in einem Liberase-Gemisch verdaut. Diese Verarbeitungsmethode befreit eine Vielzahl unterschiedlicher Zelltypen und führt zu einer Einzelzellsuspension, die keine manuelle Dissoziation gegen einen Filter erfordert, was das Überleben der Zellen fördert und eine hohe Anzahl lebender Zellen für nachgelagerte Analysen liefert. In diesem Protokoll definieren wir auch Gating-Schemata für epitheliale und myeloische Zelluntergruppen sowohl in naiven als auch in influenzainfizierten Lungen. Die gleichzeitige Isolierung von lebenden Immun- und Nicht-Immunzellen ist der Schlüssel zur Untersuchung des interzellulären Crosstalks und für ein tieferes Verständnis der Lungenbiologie bei Gesundheit und Krankheit.
Einleitung
Die Lunge besteht aus den Atemwegen, den Lungenbläschen und dem Interstitium. Immun- und Nicht-Immunzellen befinden sich in diesen Kompartimenten, um sowohl zur homöostatischen Lungenfunktion (Gasaustausch) als auch zur Abwehr des Wirts gegen Umwelteinflüsse wie Virusinfektionen beizutragen. Die großen und kleinen Atemwege, also die Bronchien und Bronchiolen, sind von Epithelzellen ausgekleidet. Die vorherrschenden Epithelzellen in diesen Regionen sind Keulen- und Flimmerzellen, die für die Sekretion von Schutzmolekülen und die Erleichterung der mukoziliären Clearance verantwortlich sind1. Die Alveolen sind die am weitesten entfernten Strukturen in der Lunge und werden von zwei Epithelzelltypen ausgekleidet, den alveolären Typ-I-Zellen (ATIs) und den alveolären Typ-II-Zellen (ATIIs). ATIs sind für den Gasaustausch verantwortlich, und ATIIs sezernieren und recyceln Tenside, um eine angemessene Oberflächenspannungzu gewährleisten 2,3. ATIIs sind selbsterneuernd und können sich auch in ATIs differenzieren, eine Rolle, die besonders nach Lungenschäden relevant ist4. Darüber hinaus bieten ATIIs eine unterstützende Nische für den wichtigsten Immunzelltyp, der die alveoläre Nische besiedelt, die Alveolarmakrophagen (AMs)5,6. Neben dem Epithel bilden Fibroblasten, Endothelzellen und interstitielle Makrophagen (IMs) (die sowohl mit Nerven als auch mit Gefäßen assoziiert sein können) das Interstitium 7,8,9,10. Als Reaktion auf Infektionen und Verletzungen sterben zahlreiche Lungenzellen ab, und Immunzellen, einschließlich Monozyten und Neutrophile, infiltrieren in das Gewebe11,12. Lungeninfiltrierende Monozyten differenzieren sich zu Makrophagen und können langfristig zum Makrophagenkompartiment beitragen13.
Derzeitige Methoden zur Herstellung einzelliger Suspensionen aus der Lunge der Maus basieren im Allgemeinen auf Kollagenase und erfordern eine physikalische Dissoziation von Gewebe14. Dies kann zu einer geringen Anzahl lebensfähiger nicht-immuner Zellpopulationen führen. Einige Protokolle zur Isolierung von Epithelzellen sind dispase-basiert und ergeben höhere Anteile an lebenden Epithelzellen; Diese Protokolle untersuchen jedoch im Allgemeinen nicht die Ausbeute und Lebensfähigkeit von Immunzellen 15,16,17. Die Durchflusszytometrie ist eine gängige Methode zur Unterscheidung von Zellpopulationen innerhalb eines verdauten Gewebes. Zu Studienbeginn ist das Durchflusszytometrie-Gating für AMs, IMs, Monozyten und Neutrophile klar abgegrenzt. Während der Entzündung wird der Gating-Prozess jedoch variabel und schwierig zu interpretieren, da sich infiltrierende Monozyten in Makrophagen differenzieren. Daher skizziert das hierin vorgestellte Protokoll auch Gating-Strategien zur Identifizierung myeloischer Zellpopulationen, die nach einer Infektion von Interesse sind.
Eine robuste Dissoziation von Lungenepithelzellen und myeloischen Zellen ist unerlässlich, um ihre homöostatischen und entzündlichen Funktionen zu erkennen. Eine Methode zur parallelen Isolierung dieser Zellkompartimente wird die nachgelagerte Analyse von Schlüsselzelltypen ermöglichen, die sowohl die Gesundheit erhalten als auch Krankheiten vorantreiben. Eine schematische Übersicht über den Arbeitsablauf dieses Protokolls finden Sie in Abbildung 1.
Protokoll
Dieses Protokoll entspricht den Richtlinien des Institutional Animal Care and Use Committee an der Harvard Medical School (Fördernummern: R35GM150816 und P30DK043351). Für die Experimente wurden weibliche C57BL/6J-Mäuse im Alter von 8-12 Wochen verwendet. Dieses Protokoll ist auch für männliche Mäuse geeignet. Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Materialien
- Tauen Sie notwendige Enzyme auf Eis auf, einschließlich Dispase, Liberase und DNAse.
- Bereiten Sie andere notwendige Reagenzien vor. Füllen Sie eine 10-ml-Spritze mit 5 mL 2 mM EDTA in DPBS und setzen Sie sie mit einer 27-G-Nadel ein. Füllen Sie die 1-ml-Spritze mit DPBS und legen Sie den Katheter an.
2. Entnahme der Lunge
- Euthanasieren Sie die Maus durch intraperitoneale Injektion von 400-500 mg/kg und 25-100 mg/kg Ketamin/Xylazin-Gemisch (gemäß institutionell anerkannten Protokollen). Fahren Sie mit dem Sezieren fort, sobald die Maus nicht mehr auf das Einklemmen des Fußpolsters reagiert (~5 Minuten).
HINWEIS: Anstelle von Kohlendioxid wird ein Ketamin/Xylazin-Gemisch zur Euthanasie verwendet, um erstickungsinduzierte Blutungen und Immunzellinfiltration zu verhindern, die die Ergebnisse verfälschen können. - Besprühen Sie die Maus mit 70% Ethanol. Präparieren Sie die Maus mit einer feinen chirurgischen Schere und einer Pinzette #7. Machen Sie mit einer Schere einen Schnitt in den Bauch und schneiden Sie seitlich durch das Bauchfell.
- Machen Sie einen kleinen Schnitt in die Membran, um das Vakuum abzulassen. Schneiden Sie das Zwerchfell und den unteren Brustkorb aus der Körperhöhle heraus, um die Lunge und das Herz freizulegen.
- Perfundieren Sie die Lunge mit 5 ml 2 mM EDTA in DPBS in einer 10-ml-Spritze, die mit einer 27-g-Nadel ausgestattet ist. Die Perfusion wird durchgeführt, indem mit der Nadel, die von rechts in den linken Ventrikel gerichtet ist, in die Basis des Herzens eingedrungen ist und langsam Flüssigkeit aus der Spritze18 abgegeben wird.
HINWEIS: Die Perfusion sollte langsam durchgeführt werden, um einen Riss des Gefäßsystems zu vermeiden. - Öffnen Sie den Brustkorb am Brustbein, indem Sie Seiten des Brustkorbs wegschneiden, und schneiden Sie dann vertikal durch das Brustbein, um die Luftröhrefreizulegen 19. Schneiden Sie mit einer feinen Schere und einer Pinzette #7 so viel Muskel- und Bindegewebe wie möglich ab, ohne die Luftröhre oder die Lunge zu punktieren.
- Wickeln Sie die Luftröhre in eine Naht (Größe 2-0), als ob Sie sie abbinden wollten, aber ohne sie festzuziehen. Schneiden Sie die Luftröhre seitlich ein und führen Sie den Katheter ein. Befestigen Sie die Naht fest um den Katheter, indem Sie die Naht festziehen. Führen Sie den Katheter nicht mehr als 1 cm in die Lunge ein.
- Blasen Sie die Lunge mit 1 ml DPBS auf. Ziehen Sie das DPBS heraus, indem Sie die Spritze langsam zurückziehen. Blasen Sie die Lunge mit demselben DPBS wieder auf und ziehen Sie die Spritze erneut zurück, um bronchoalveoläre Lavageflüssigkeit (BALF) zu entnehmen.
- Trennen Sie die Spritze vom Katheter und lassen Sie den Katheter eingeführt. Geben Sie BALF in ein Mikrozentrifugenröhrchen.
- Füllen Sie dieselbe 1-ml-Spritze mit 1 ml Dispase und befestigen Sie sie wieder an dem Katheter. Geben Sie eine Spritze ab, um die Lunge mit Dispase aufzublasen. Während Sie den Katheter entfernen, ziehen Sie die Naht um die Luftröhre fest, um ein Austreten der Dispase zu verhindern.
- Schneiden Sie die Luftröhre seitlich durch. Entfernen Sie die Lunge aus der Körperhöhle, indem Sie das Bindegewebe entlang der Rückseite des Brustkorbs durchtrennen, während Sie die Lunge und die Luftröhre mit einer Pinzette nach oben ziehen.
- Entferne das Herz aus der Lunge. Legen Sie die Lunge in 5 ml DPBS auf Eis.
- Nehmen Sie in diesem Schritt das abgetrennte BALF und schleudern Sie es bei 400 x g für 5 min bei 4 °C herunter. Der Überstand kann bei Bedarf aliquotiert und gelagert werden. Es sollte ein sichtbares Zellpellet vorhanden sein, das in 100 μl RPMI resuspendiert werden kann.
HINWEIS: Man kann bis zu 2 Stunden warten, um mit der Verdauung fortzufahren, wodurch mehrere Mäuse gleichzeitig geerntet werden können.
3. Verdauung der Lunge
- Bereiten Sie die Digest-Mischung vor. Fügen Sie 83 μg/ml Liberase (50 μl Stammlösung) und 100 μg/ml DNAse (15 μl Stammlösung) in 3 ml RPMI pro Lunge hinzu.
- Präparieren Sie die fünf Lungenlappen und entsorgen Sie jegliches Bindegewebe19,20. Die Lunge mit einer Schere 1 min auf einem Objektträger zerkleinern.
- Übertragen Sie die gehackte Lunge mit einer Sezierschere in ein 50-ml-Zentrifugenröhrchen. Geben Sie aus BALF gewonnenes und in RPMI resuspendiertes Zellpellet in das Zentrifugenröhrchen. Geben Sie 3 ml Aufschlussmix mit einer serologischen 5-ml-Pipette in das Röhrchen mit der Probe.
- Pipettieren Sie die Lungenverdaumischung 2-3 Mal auf und ab. Bei 37 °C bei 140 U/min in einen Orbitalschüttler geben, wobei die Aufschlussröhrchen 40 Minuten lang in einem 45-Grad-Winkel angeordnet sind.
4. Vorbereiten der einzelligen Suspension
- Nehmen Sie die 50-ml-Zentrifugenröhrchen aus dem Orbitalschüttler und legen Sie sie auf Eis. Pipettieren Sie die Lungenverdauungsmischung 5-6 Mal auf und ab. Filtern Sie durch ein 70 μm Zellsieb in ein neues 50 mL Röhrchen. Waschen Sie alle verbleibenden Zellen durch den Filter und neutralisieren Sie die Enzyme mit 10 mL 5% FBS in RPMI.
- 5 min bei 4 °C bei 600 x g schleudern. Saugen Sie den Überstand mit einem Vakuumsauger oder einer Pipette ab. In 1 ml ACK-Lysepuffer resuspendieren und 3 Minuten bei Raumtemperatur inkubieren, um rote Blutkörperchen (RBCs) zu lysieren. Fügen Sie 9 mL PBS hinzu und pipettieren Sie auf und ab.
- 5 min bei 4 °C bei 600 x g schleudern. Überstand mit einem Vakuumaspirator oder einer Pipette aspirieren. In 1 ml FACS-Puffer (1 % FBS in PBS) resuspendieren und mit einer p1000-Pipette durch ein 64-μm-Netz in ein Mikrozentrifugenröhrchen filtrieren.
5. Durchflusszytometrie und Downstream-Analysen
- Wenn Sie eine Durchflusszytometrie oder eine fluoreszenzaktivierte Zellsortierung in einer 96-Well-Platte durchführen, färben Sie etwa 1-2 Millionen Zellen pro Well oder einen Anteil von 8 % der Lungensuspension.
- Schleudern Sie die Zellen nach unten. Alle Spins in einer 96-Well-Platte sollten 2,5 min (4 °C) bei 600 x g durchgeführt werden. Schalten Sie den Überstand ab und waschen Sie die Zellen einmal, indem Sie in 200 μl DPBS resuspendieren. Drehen Sie nach unten und schnippen.
- Wenn Zellen für die Durchflusszytometrie-Analyse gefärbt werden sollen, fahren Sie mit dem folgenden Färbeverfahren fort.
- Resuspendieren Sie Zellen in lebenden/toten Zombie-Flecken (1:150) und Fc-Blöcken (1:250) in 25 μl DPBS für 10 min bei Raumtemperatur im Dunkeln.
- Bereiten Sie die Antikörper-Färbemischung in einer 2-fachen Konzentration im FACS-Puffer vor.
HINWEIS: Eine Färbemischung sollte alle Marker des myeloischen Panels (Tabelle 1) oder des Epithelpanels (Tabelle 2) in den angegebenen Konzentrationen enthalten. - 25 μl Färbemischung zu 25 μl Lungensuspension in eine Platte geben und 30 Minuten im Dunkeln auf Eis inkubieren. Das Gesamtfärbevolumen sollte nun 50 μl betragen, und die Primärantikörper sollten ihre endgültige 1x-Färbekonzentration erreicht haben.
- 150 μl FACS-Puffer zugeben, 2,5 min bei 4 °C bei 600 x g herunterschleudern und den Überstand abschnippen. Zweimal in 200 μl FACS-Puffer waschen.
- Wenn eine intrazelluläre Färbung erforderlich ist, fixieren Sie die Zellen mit einem intrazellulären Fixierungskit. Wenn keine intrazelluläre Färbung erforderlich ist, können die Zellen für 20 Minuten in 4 % PFA in DPBS fixiert werden.
- Waschen Sie das Fixiermittel dreimal mit 200 μl FACS-Puffer ab. Die Proben können resuspendiert in 200 μl FACS-Puffer bei 4 °C im Dunkeln für 2-3 Tage gelagert werden. Vor der Probenentnahme können Zählbeads hinzugefügt werden, um die Zellzahl zu quantifizieren.
- Wenn Zellen sortiert werden sollen, fahren Sie mit dem folgenden Färbeverfahren fort.
- Resuspendieren Sie die Zellen in einer 1x Färbe-Antikörpermischung mit Fc-Block (1:250). 30 min im Dunkeln auf Eis inkubieren.
- 150 μl FACS-Puffer zugeben, 2,5 min bei 4 °C bei 600 x g herunterschleudern und den Überstand abschnippen. Dreimal mit 200 μl FACS-Puffer waschen und vor dem Sortieren in 200 μl FACS-Puffer resuspendieren.
HINWEIS: Es wird empfohlen, den Zellen vor dem Sortieren einen Viabilitätsfarbstoff wie DAPI zuzusetzen.
Ergebnisse
Ein erfolgreicher Verdau führt zu etwa 20-25 Millionen Zellen mit einer Lebensfähigkeit von 90 % bis 95 %. Wenn etwa 25.000 Zählperlen zu einer 8%igen Fraktion der Lunge hinzugefügt werden, sollten die Kügelchen 1%-3% der gesammelten Ereignisse beeinträchtigen. Nach dem Gating auf Singuletts sollten etwa 90 % bis 95 % der Zellen Zombie Aqua-negativ sein (was auf die Lebensfähigkeit hinweist) (Abbildung 2A, Abbildung 3A).
Von CD45+-Zellen werden CD64+F4/80+-Zellen als Makrophagen definiert (Abbildung 2B). Zu Studienbeginn sind 80%-90% aller Makrophagen in der Lunge als AMs (Siglec-F+CD11c+) definiert, und der Rest kann als IMs (Siglec-F-CD11c-) klassifiziert werden (Abbildung 2C). Während einer Infektion und Entzündung verschiebt sich diese Definition jedoch, und das IM-Gating enthält neben IMs (Siglec-F-CD11clo/hi) auch Monozyten-abgeleitete Makrophagen (moMacs). Darüber hinaus verschiebt sich das Verhältnis 9 Tage nach der Infektion (dpi) auf etwa 4 % AMs und 90 % IMs/moMacs (Abbildung 2C).
Zellen, die CD64-F4/80+ sind, können durch Siglec-F und Ly6C weiter gegated werden. Siglec-F+-Zellen sind Eosinophile (Abbildung 2D). Ly6C+Siglec-F-CD11b+ Zellen können als Monozyten identifiziert werden (Abbildung 2D). Zellen, die sowohl für CD64 als auch für F4/80 negativ sind (Abbildung 2B), können weiter als CD11b+Ly6G+ gated werden, um Neutrophile zu identifizieren (Abbildung 2E).
Um Epithelzellen zu gaten, müssen zunächst CD45+-Zellen ausgeschaltet werden (Abbildung 3). Anschließend können Endothelzellen (CD31+) und Fibroblasten (Pdgfra+) identifiziert werden (Abbildung 3B). Anschließend werden CD31-Pdgfra-Zellen, die EpCAM+ sind, als Epithelzellen identifiziert (Abbildung 3C). Epithelzellen können weiter unterteilt werden in ATIIs (MHC-II+CD104-), Atemwegszellen (Club- und Flimmerzellen) (CD104+) und andere Epithelzellen (MHC-II-CD104-) (Abbildung 3D). Der Anteil der ATII-Zellen nimmt während der Infektion ab.

Abbildung 1: Schematische Darstellung des Protokolls. Die Lungen von Mäusen werden durchblutet, mit Dispase aufgeblasen und präpariert. Nach dem Zerkleinern werden sie in einem Libese/DNAse-Gemisch verdaut und 40 Minuten lang geschüttelt. Die Verdaue werden durch ein Zellsieb geleitet und die Erythrozyten werden lysiert. Nach der Resuspension in FACS-Puffer können die Zellen vor nachgelagerten Anwendungen, einschließlich der Durchflusszytometrie, plattiert und gefärbt werden. Diese Figur wurde mit BioRender erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Myeloische Zell-Gating-Strategie. Repräsentatives Gating von Durchflusszytometrie-Analysen von Mauslungen, die 9 Tage oder 14 Tage nach der Infektion (dpi) mit Influenza A/Puerto Rico/8/34 (H1N1) nicht infiziert sind. (A) Gating von lebenden CD45+-Zellen. (B) CD45+-Zellen, die mit CD64 durch F4/80 gesteuert werden. (C) CD64+F4/80+-Zellen (Makrophagen), die unter Verwendung von Siglec-F durch CD11c in AMs und IMs/moMacs gekapselt sind. (D) CD64-F4/80+-Zellen, die in Eosinophile und Monozyten gebunden sind. (E) CD64-F4/80-Zellen zur Identifizierung von Neutrophilen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
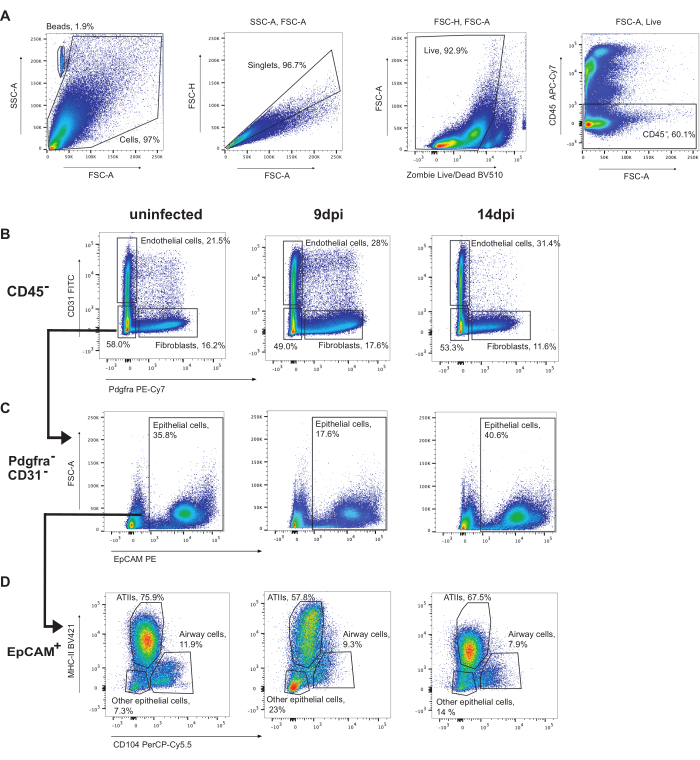
Abbildung 3: Gating-Strategie der Epithelzelle. Repräsentatives Gating von Durchflusszytometrie-Analysen von nicht infizierten Mauslungen, 9 dpi oder 14 dpi mit Influenza A/Puerto Rico/8/34 (H1N1). (A) Gating von lebenden CD45-Zellen. (B) CD45-Zellen, die von Pdgfra (Fibroblasten) an CD31 (Endothelzellen) gebunden sind. (C) CD31-Pdgfra-EpCAM+-Zellen sind Epithelzellen. (D) Gating-Epithelzellen MHC-II durch CD104 identifiziert ATIIs (MHC-II+, CD104-), Atemwegsepithelzellen (einschließlich Flimmer- und Keulzellen) (CD104+) und andere Epithelzellen (MHC-II-CD104-). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Antikörper | Fluorophor | Färbekonzentration | Klonen |
| Anti-Maus CD11c | AF-488 | 1:300 | Nr. N418 |
| Anti-Maus CD170 (Siglec-F) | PE | 1:200 | 1RNM44N |
| Anti-Maus CD45 | BV711 | 1:200 | 30-F11 |
| Anti-Maus CD64 (FcγRI) | APC | 1:200 | X54-5/7.1 |
| Anti-Maus F4/80 | PE/Cy7 | 1:100 | BM8 |
| Anti-Maus Ly-6C | BV605 | 1:500 | HK1.4 |
| Anti-Maus Ly-6G | PerCP/Cyanin5,5 | 1:300 | 1A8 |
| gegen Maus/Mensch CD11b | BV421 | 1:800 | M1/70 |
| Lebender/toter Fleck | BV510 | 1:150 | n.a. |
Tabelle 1: Antikörperindex für myeloisches Panel. Antikörper, die für die myeloische Gating-Strategie verwendet werden.
| Antikörper | Fluorophor | Färbekonzentration | Klonen |
| Anti-Maus CD104 | PerCP/Cyanin5,5 | 1:200 | 346-11A |
| Anti-Maus CD140a (Pdgfra) | PE/Cyanin7 | 1:200 | APA5 |
| Anti-Maus CD31 | FITC | 1:200 | 390 |
| Anti-Maus CD326 (Ep-CAM) | PE | 1:200 | G8.8 |
| Anti-Maus CD45 | APC/Cyanin7 | 1:200 | 30-F11 |
| Anti-Maus I-A/I-E (MHC-II) | BV421 | 1:400 | M5/114.15.2 |
| Lebender/toter Fleck | BV510 | 1:150 | n.a. |
Tabelle 2: Antikörperindex für das Epithelpanel. Antikörper, die für die epitheliale Gating-Strategie verwendet werden.
Diskussion
Dieses Protokoll beschreibt einen Lungenverdau der Maus, der etwa 20-25 Millionen Zellen pro Maus mit einer Lebensfähigkeit von 90 % bis 95 % isoliert. Es ermöglicht zusätzlich die Sammlung von BALF für weitere Analysen. Die resultierende Zellsuspension ist mit mehreren Labortechniken kompatibel, einschließlich Durchflusszytometrie und fluoreszenzaktivierter Zellsortierung, um Zellen für die Sequenzierung oder Zellkultur zu isolieren. Kurz gesagt, nach der Perfusion wird BALF gesammelt und die Lunge wird mit Dispase aufgebläht. Die Lungen werden dann gehackt und in einer Libese/DNase-Lösung verdaut. Nach der Lyse und Filterung kann mit nachgelagerten Anwendungen fortgefahren werden, einschließlich der durchflusszytometrischen Analyse myeloischer und epithelialer Untergruppen während einer Influenzavirusinfektion.
Wenn BALF nicht entnommen werden kann und/oder die Lunge nicht richtig aufgeblasen bleibt, kann dies an einer falschen Katheterplatzierung liegen. Wenn der Katheter zu weit in die Luftröhre/Bronchien eingeführt wird, kann er durch das Gewebe in das Bauchfell brechen. Dies führt zu einer fehlenden Inflation und der Unfähigkeit, BALF abzurufen. Wenn sich die Lunge aufgebläht hat, aber keine Flüssigkeit aus einem oder mehreren Lungenlappen gezogen werden kann, kann dies daran liegen, dass der Katheter in einen Bronchus geleitet wurde. Wenn Sie den Katheter etwas weiter herausziehen, sollte dieses Problem behoben werden. Eine ausreichende Durchblutung ist erforderlich, um eine Kontamination durch zirkulierende Immunzellen zu eliminieren21. Bei schwer geschädigten Lungen können Blutungen und eine verminderte Integrität der Barriere die Lungenbläschen anfälliger für das Platzen durch den Perfusionsdruckmachen 22. Daher ist es wichtig, Mäuse mit geschädigten Lungen sehr langsam zu perfundieren.
Im Folgenden finden Sie einige Richtlinien für Best Practices bei der Durchflusszytometrie-Färbung. Wenn eine Siglec-F+CD11c-Population im Makrophagen-Gate (CD45+CD64+F4/80+) vorhanden ist, handelt es sich wahrscheinlich um eine Kontamination durch Eosinophile. Wir haben festgestellt, dass Eosinophile sowohl im PE- als auch im BV605-Kanal autofluoreszierend sind - daher ist es wichtig, die Verwendung eines CD64-Antikörpers, der mit diesen Fluorophoren konjugiert ist, zu vermeiden. Darüber hinaus können bei dieser Verdauungsmethode zwar lebende Lymphozyten isoliert werden, aber viele lymphozytenspezifische Oberflächenmarker wie CD4 und CD8 werden dabei gespalten. Daher ist dieses Protokoll nicht für die durchflusszytometrische Analyse von T-Zellpopulationen geeignet. In solchen Fällen kann ein Kollagenase-basierter Ansatz eine effektivere Alternative sein23,24.
Es gibt viele experimentelle Fragen, die die Analyse sowohl der Immun- als auch der Nicht-Immunfraktionen einer einzigen Maus erfordern25,26. Bei der Untersuchung von Wechselwirkungen zwischen verschiedenen Zelltypen ist es beispielsweise entscheidend, Populationen aus einer einzigen Maus zu sammeln und zu analysieren, um potenzielle Artefakte zu minimieren, die aufgrund biologischer Variabilität zwischen einzelnen Tieren entstehen können. Darüber hinaus ermöglicht der Vergleich von immunen und nicht-immunen Zellpopulationen aus derselben Mikroumgebung ein vollständigeres Verständnis der Gewebedynamik und ihrer Rolle sowohl bei der Aufrechterhaltung der Homöostase als auch bei der Steuerung von Krankheitsprozessen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde zum Teil durch Zuschüsse der National Institutes of Health (R35GM150816 und P30DK043351), der Charles H. Hood Foundation und des Harvard Stem Cell Institute unterstützt. Wir danken Alexander Mann und allen anderen Mitgliedern des Franklin-Labors für ihre Hilfe und ihren Rat bei der Entwicklung und Verfeinerung der Durchflusszytometrie-Gating-Schemata und -Analysen. Wir danken auch dem Immunology Flow Cytometry Core an der Harvard Medical School. Die Durchflusszytometrie-Analyse wurde mit FlowJo durchgeführt. Die Schaltpläne der Abbildungen wurden mit BioRender erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringe with Slip Tip | VWR | BD309659 | |
| 1.7 mL microcentrifuge tube | DOT Scientific | RN1700-GMT | |
| 10 mL pipettes (disposable) | Fisher Scientific | 12-567-603 | |
| 10 mL Syringe with BD Luer-Lok Tip | VWR | 75846-756 | |
| 123 count eBeads Counting Beads | Thermo Scientific | 01-1234-42 | |
| 12-channel pipette (30-300ul) | USA Scientific | 7112-3300 | |
| 16% paraformaldehyde | VWR | 100503-917 | |
| 23 G needle with regular bevel | VWR | 305194 | |
| 27 G needle with regular bevel | VWR | BD305109 | |
| 5 mL pipettes (disposable) | Thermo Fisher Scientific | 170373 | |
| 50 mL centrifuge tubes | Olympus | 28-108 | |
| 96-well round bottom plate | Corning | 3797 | |
| ACK lysing buffer | Gibco | A100492-01 | |
| Alexa Fluor 488 anti-mouse CD11c | BioLegend | 117311 | |
| Anti-F4/80 Rat Monoclonal Antibody (PE (Phycoerythrin)/Cy7) | BioLegend | 123114 | |
| APC anti-mouse CD64 (FcγRI) | BioLegend | 139306 | |
| APC/Cyanine7 anti-mouse CD45 | BioLegend | 103115 | |
| BD Insyte Autoguard Shielded IV Catheters | VWR | 381423 | |
| Brilliant Violet 421 anti-mouse I-A/I-E (MHC-II) | BioLegend | 107632 | |
| Brilliant Violet 421 anti-mouse/human CD11b | BioLegend | 101235 | |
| Brilliant Violet 605 anti-mouse Ly-6C | BioLegend | 128036 | |
| Brilliant Violet 711 anti-mouse CD45 | BioLegend | 103147 | |
| C57BL/6J mice | Jackson Laboratories | ||
| Cd140a (PDGFRA) Monoclonal Antibody (APA5), PE-Cyanine7, eBioscience | Life Technologies | 25-1401-82 | |
| CD170 (Siglec F) Monoclonal Antibody (1RNM44N), PE | Life Technologies | 12170280 | |
| Cell strainers | Corning | 352350 | |
| Centrifuge | Eppenodorf | Centrifuge 5910R | |
| Deoxyribonuclease I from bovine pancreas (DNase) | Millipore Sigma | DN25-100MG | Reconstituted at 20 mg/mL in DPBS as stock solution stored at -20 °C |
| Dispase | VWR | 76176-668 | Thawed once and stored as 1mL aliquots at -20 °C |
| Dissection forceps (Dumont #7) | Fine Science Tools | 11297-00 | |
| Dissection scissors | Fine Science Tools | 14060-09 | |
| DPBS | Thermo Fisher Scientific | 14190250 | |
| eBioscience fixation kit | Life Technologies | 00-5523-00 | |
| EDTA | Life Technologies | AM9260G | |
| Ethanol | VWR | TX89125170HU | |
| FBS | GeminiBio | 100-106 | Thawed once and heat-inactivated before long-term storage as aliquots at -20 °C |
| FITC anti-mouse CD31 Antibody | BioLegend | 102406 | |
| Gibco RPMI 1640 Medium | Fisher Scientific | 11-875-093 | |
| Glass slides | Fisher Scientific | 12-552-3 | |
| graduated reservoir | USA Scientific | 1930-2235 | |
| Ice bucket | Corning | 432128 | |
| Ketamine hydrocholoride injection (100 mg/mL) | Dechra | Ketamine and xyalazine euthanization mixture can be kept at 30 mg/mL ketamine hydrochloride and 4.5mg/mL xylazine in sterile DPBS for up to one month. | |
| Liberase | Millipore Sigma | 5401119001 | Reconstituted at 5 mg/mL in DPBS as stock solution stored at -20 °C |
| Lids for 96-well plates | Fisher Scientific | 07-201-731 | |
| Orbital Incubator Shaker | Barnstead Lab-Line | SHKE4000 | |
| p1000 pipette | Eppenodorf | 3123000063 | |
| p1000 tips | USA Scientific | 1122-1830 | |
| p200 pipette | Eppenodorf | 3123000055 | |
| p200 tips | USA Scientific | 1110-1700 | |
| PE anti-mouse CD326 (Ep-CAM) | BioLegend | 118206 | |
| PerCP/Cyanine5.5 anti-mouse CD104 Antibody | BioLegend | 123614 | |
| PerCP/Cyanine5.5 anti-mouse Ly-6G | BioLegend | 127616 | |
| Pipet-Aid | Drummond | 4-000-101 | |
| Purified anti-mouse CD16/32 | BioLegend | 101302 | Referred to as "Fc block" in text |
| Spray bottle | VWR | 23609-182 | |
| Suture (Size 2-0) | VWR | 100190-026 | |
| Underpads | VWR | 56617-014 | |
| Xysed (xylazine 100mg/mL) | Pivetal | See ketamine hydrocholoride notes above. | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
Referenzen
- Wanner, A., Salathé, M., O'Riordan, T. G. Mucociliary clearance in the airways. Am J Respir Crit Care Med. 154 (6), 1868-1902 (1996).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. Am Rev Respir Dis. 115 (1), 81-91 (1977).
- Fehrenbach, H. Alveolar epithelial type II cell: defender of the alveolus revisited. Respir Res. 2 (1), 33-46 (2001).
- Basil, M. C., Alysandratos, K. -. D., Kotton, D. N., Morrisey, E. E. Lung repair and regeneration: Advanced models and insights into human disease. Cell Stem Cell. 31 (4), 439-454 (2024).
- Hussell, T., Bell, T. J. Alveolar macrophages: plasticity in a tissue-specific context. Nat Rev Immunol. 14 (2), 81-93 (2014).
- Gschwend, J., et al. Alveolar macrophages rely on GM-CSF from alveolar epithelial type 2 cells before and after birth. J Exp Med. 218 (1), e20210745 (2021).
- Gillich, A., et al. Capillary cell-type specialization in the alveolus. Nature. 586 (7831), 785-789 (2020).
- Schyns, J., et al. Non-classical tissue monocytes and two functionally distinct populations of interstitial macrophages populate the mouse lung. Nat Commun. 10 (1), 3964 (2019).
- Chakarov, S., et al. Two distinct interstitial macrophage populations coexist across tissues in specific subtissular niches. Science. 363 (6432), eaat3773 (2019).
- Tsukui, T., et al. Collagen-producing lung cell atlas identifies multiple subsets with distinct localization and relevance to fibrosis. Nat Commun. 11 (1), 1920 (1920).
- Aegerter, H., et al. Influenza-induced monocyte-derived alveolar macrophages confer prolonged antibacterial protection. Nat Immunol. 21 (2), 145-157 (2020).
- Johansson, C., Kirsebom, F. C. M. Neutrophils in respiratory viral infections. Mucosal Immunol. 14 (4), 815-827 (2021).
- Li, F., et al. Monocyte-derived alveolar macrophages autonomously determine severe outcome of respiratory viral infection. Sci Immunol. 7 (71), eabj5761 (2022).
- Moll, H. P., et al. Orthotopic transplantation of syngeneic lung adenocarcinoma cells to study PD-L1 expression. J Vis Exp. (143), e58101 (2019).
- Warshamana, G. S., Corti, M., Brody, A. R. TNF-α, PDGF, TGF-β1 expression by primary mouse bronchiolar-alveolar epithelial and mesenchymal cells: TNF-α induces TGF-β1. Exp Mol Pathol. 71 (1), 13-33 (2001).
- Corti, M., Brody, A. R., Harrison, J. H. Isolation and primary culture of murine alveolar type II cells. Am J Respir Cell Mol Biol. 14 (3), 309-315 (1996).
- Quantius, J., et al. Influenza virus infects epithelial stem/progenitor cells of the distal lung: Impact on Fgfr2b-driven epithelial repair. PLoS Pathog. 12 (5), e1005544 (2016).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. BIO Protoc. 11 (8), e3988 (2021).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Bijgaart, R. J. E., van den Kong, N., Maynard, C., Plaks, V. Ex vivo live imaging of lung metastasis and their microenvironment. J Vis Exp. (108), e53741 (2016).
- Shi, W., et al. Isolation and purification of immune cells from the liver. Int Immunopharmacol. 85, 106632 (2020).
- Short, K. R., et al. Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J. 47 (3), 954-966 (2016).
- Laidlaw, B. J., et al. CD4+ T cell help guides formation of CD103+ lung-resident memory CD8+ T cells during influenza viral infection. Immunity. 41 (4), 633-645 (2014).
- D'Agostino, M. R., et al. Protocol for isolation and characterization of lung tissue-resident memory T cells and airway-trained innate immunity after intranasal vaccination in mice. STAR Protoc. 3 (2), 101652 (2022).
- Waal, A. M., de Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Bhattacharya, J., Westphalen, K. Macrophage-epithelial interactions in pulmonary alveoli. Semin Immunopathol. 38 (4), 461-469 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten