Method Article
Bekämpfung von Aedes albopictus Mückenlarven mit Carpesium abrotanoides L.
In diesem Artikel
Zusammenfassung
Die Verwendung der Pflanze Carpesium abrotanoides L. zur Bekämpfung von Mückenlarven kann die Population der Aedes albopictus-Mücke effektiv reduzieren und eine Grundlage für die Entwicklung pflanzlicher Insektizide bilden.
Zusammenfassung
Als lebenswichtiger Überträger von Dengue-Fieber, Gelbfieber und anderen durch Mücken übertragenen Krankheiten kann Aedes albopictus (Diptera: Culicidae) weltweit weit verbreitet sein und eine ernsthafte Bedrohung für die öffentliche Gesundheit darstellen. Angesichts der schnell aufkommenden Insektizidresistenz bei der Mücke ist die Entwicklung neuer botanischer Insektizide zur Bekämpfung und Reduzierung von Ae. albopictus bis heute dringend und entscheidend. Um die Abkochwirkung der Pflanze C. abrotanoides L. auf die Abtötung von Mückenlarven zu untersuchen, haben wir daher die Mortalität von Larven nach Behandlung mit unterschiedlichen Konzentrationen (60 mg/ml, 120 mg/ml und 180 mg/ml) Abkochung innerhalb einer Reihe von Zeitpunkten (12 h, 24 h, 36 h und 48 h) nachgewiesen. Wir fanden heraus, dass eine 24-stündige Behandlung mit 180 mg/ml C. abrotanoides L. Abkochung 92,35% der Mücken im Vergleich zur Kontrollbehandlung tötete. In der Zwischenzeit könnten 36 h mit 120 mg/ml auch mehr als 90% der Mücken töten. Darüber hinaus waren die Populationen von Carassius auratus 36 Stunden lang einer Abkochung von 120 mg/ml C. abrotanoides L. ausgesetzt und starben nicht. Die Mortalitätsbewertung ergab, dass diese Konzentration kein schädliches Maß an ökologischer Umweltbelastung darstellt. Diese Studie liefert einen möglichen Pflanzenkandidaten, der für die Entwicklung von Insektiziden pflanzlichen Ursprungs verwendet werden könnte. Darüber hinaus können diese Methoden verändert und auf andere Mückenarten angewendet werden.
Einleitung
Aedes albopictus, auch bekannt als "Asiatische Tigermücke", kann eine Vielzahl von Krankheiten wie Dengue-Fieber, Chikungunya-Fieber und Zika-Viruskrankheit übertragen, indem es menschliches und tierisches Blut saugt1. Aufgrund der weiten Verbreitung von Ae. albopictus hat sich die epidemische Situation durch durch Stechmücken übertragene Krankheiten wie das Dengue-Fieber in den letzten Jahren immer weiter verschärft und stellt eine ernsthafte Bedrohung für das Leben und die Gesundheit der Menschen weltweit dar2. Derzeit gibt es für die meisten durch Mücken übertragenen Krankheiten keinen wirksamen Impfstoff oder ein spezifisches therapeutisches Medikament. Das Töten von Mücken mit chemischen Insektiziden ist nach wie vor das wichtigste Mittel zur Bekämpfung von durch Mücken übertragenen Krankheiten3. Die chemische Bekämpfungsmethode mit chemischen Insektiziden kann Mücken schnell und effizient töten und hat sich zum Hauptmittel zur Bekämpfung von Mückenvektoren entwickelt4. Der langfristige und großflächige Einsatz von Insektiziden hat jedoch zu einem Rückgang der Empfindlichkeit von Ae. albopictus gegenüber Insektiziden und der Insektizidresistenz geführt, was zum größten Hindernis bei der Bekämpfung von durch Stechmücken übertragenen Krankheiten geworden ist. Daher ist es von großer praktischer Bedeutung, eine neue Art von Mückeninsektiziden mit hoher Effizienz, Sicherheit und Umweltschutz zu entwickeln.
In der Natur sind Pflanzen die Hauptproduzenten. Insekten und viele Tiere fressen Pflanzen. Wenn Pflanzen unter verschiedenen "Naturkatastrophen und menschengemachten Katastrophen" leiden, produzieren sie Sekundärmetaboliten, um zu überleben. Diese Substanzen haben oft die Fähigkeit, der Nahrungs-, Krankheits- und Insektenresistenz anderer Organismen zu widerstehen. Sie wirken nicht nur auf eine Vielzahl von Schädlingen, sondern haben auch ein geringes Risiko für Umwelttoxizität5. Carpesium abrotanoides L. ist ein mehrjähriges Kraut der Gattung Carpesium abrotanoides der Compositae, die auch als "Krötenblau", "Hirschgras", "wilder Tabak" usw. bekannt ist. Es ist in China und Ostasien weit verbreitet. Seine Stängel und Blätter können in diesen Bereichen als Insektizide zur Behandlung von Schürfwunden und Fieber eingesetzt werden6. Seine Frucht ist in China lokal als "Bei-He-Shi" bekannt und wird in der Volksmedizin zur Behandlung von Bandwürmern und Ascaris lumbricoiden verwendet 7,8. Es wurde berichtet, dass die Pflanze reich an Monoterpenen, Sesquiterpenen, Phenolen und anderen charakteristischen Bestandteilen ist und wirksame pharmakologische Wirkungen hat, wie z. B. entzündungshemmende, antimykotische, antiparasitäre, antitumorale und antivirale Wirkungen7. Jüngste Studien haben gezeigt, dass es eine antifütternde Wirkung auf Spodoptera exigua9, eine Kontakttoxizität für Sitophilus zeamais10, eine abtötende Fähigkeit für cysticercus cellulosae von Taenia asiatica8, eine antifütternde Wirkung und eine Kontakttoxizität für Heerwürmer und Plutella xylostella11 hat. Erste Fortschritte wurden bei der Untersuchung der toxischen Wirkungen von C. abrotanoides L. auf einige Parasiten, landwirtschaftliche Schädlinge und sanitäre Schädlinge erzielt, die zur Bekämpfung der Larven von Aedes albopictus eingesetzt werden können.
In dieser Studie wird das Protokoll zur Kontrolle von Ae. albopictus-Larven mit C. abrotanoides L. diskutiert. In diesem Protokoll wurde die Abkochung von C. abrotanoides L. verwendet, um auf die Larven des vierten Stadiums von Ae. albopictus einzuwirken, und der Tod der Larven wurde nach Behandlung mit C. abrotanoides L. Abkochung in verschiedenen Konzentrationen (60 mg/ml, 120 mg/ml und 180 mg/ml) zu einer Reihe von Zeitpunkten (12 h, 24 h, 36 h, und 48 h). Die Bestimmung der abtötenden Wirkung von C. abrotanoides L. Abkochung auf Ae. albopictus-Larven bietet eine neue Idee für eine weitere Mückenbekämpfung mit hoher Effizienz, geringer Toxizität und dem Einsatz umweltfreundlicher pflanzlicher Insektizide.
Protokoll
Das Ziegenblut, das zur Fütterung weiblicher Mücken verwendet wird, wurde in einem örtlichen Schlachthof in Duyun City, Guizhou, China, gesammelt und gemäß den ethischen Richtlinien und Vorschriften des Key Laboratory of Human Parasitic Diseases in der Präfektur Qiannan, Duyun, Guizhou, China, verwendet.
1. Vorbereitung der Reagenzien
HINWEIS: In der Materialtabelle finden Sie eine Liste der Geräte, Reagenzien und anderen Verbrauchsmaterialien, die in diesem Protokoll verwendet werden.
- Extraktion und Identifizierung von C. abrotanoides L.
- Sammeln Sie das ganze Gras von C. abrotanoides L. Das ganze Gras von C. abrotanoides L. in dieser Studie wurde im April 2021 im Autonomen Kreis Sandu Shui in der Provinz Guizhou (N: 25,95, E: 107,87) gesammelt.Die Fotos von der Sammelstelle für C. abrotanoides L. in Abbildung 1.
ANMERKUNG: Entsprechend der Ressourcenverteilung, den medizinischen Eigenschaften, der Gewebestruktur und den physikalischen und chemischen Identifizierungsmerkmalen von C. abrotanoides L. ist die Identifizierung von C. abrotanoides L. war wie folgt: Die ganze Pflanze ist 30-100 cm hoch, mit aufrechten Stielen, viele Zweige im oberen Teil, abwechselnde Blätter im unteren Teil des Stängels, leicht gestielt, ovale Blätter, 10-15 cm lang und 5-8 cm breit, voll oder unregelmäßig gezackt, Blätter im oberen Teil des Stängels sind fast sitzend, lang oval, Nach oben hin allmählich kleiner, und der Kopf ist axillär, fast sitzend, mit hängenden Blüten, besonderem Gas, leichtem Geschmack und scharf. Die Pflanze wurde von Lehrern, die sich auf traditionelle chinesische Medizin spezialisiert haben, an unseren Standorten als C. abrotanoides L. identifiziert.
- Sammeln Sie das ganze Gras von C. abrotanoides L. Das ganze Gras von C. abrotanoides L. in dieser Studie wurde im April 2021 im Autonomen Kreis Sandu Shui in der Provinz Guizhou (N: 25,95, E: 107,87) gesammelt.Die Fotos von der Sammelstelle für C. abrotanoides L. in Abbildung 1.
- C. abrotanoides L. Reinigen, Trocknen und Zerkleinern
- Entfernen Sie die gesammelten C . abrotanoides L. von den verunreinigten Blättern und Erde und reinigen Sie sie. 10-15 Tage an der Luft unter belüfteten Bedingungen trocknen lassen oder im trockenen Ofen bei 95 °C für 6 h trocknen.
HINWEIS: Während des Trocknungsprozesses von C. abrotanoides L. muss es umgedreht werden, damit es gleichmäßig trocknen kann. Wenn das Gewebe von C. abrotanoides L. während des Zerkleinerungsprozesses nicht leicht zerkleinert werden kann, kann es erneut getrocknet und dann zerkleinert werden.
- Entfernen Sie die gesammelten C . abrotanoides L. von den verunreinigten Blättern und Erde und reinigen Sie sie. 10-15 Tage an der Luft unter belüfteten Bedingungen trocknen lassen oder im trockenen Ofen bei 95 °C für 6 h trocknen.
- Zubereitung von C. abrotanoides L. Essenz-Abkochung
- 360 g raffiniertes Pulver von C. abrotanoides L. abwiegen, 1000 ml destilliertes Wasser hinzufügen und 2 h lang bei langsamem Feuer (Leistung 800 W) dekotieren.
- Filtern Sie den Sud mit gewöhnlichem Filterpapier und konzentrieren Sie ihn dann in einem Rotationsverdampfer, um ein Extraktum herzustellen. Verdünnen Sie das Extraktum mit destilliertem Wasser auf 1000 ml und bereiten Sie einen C. abrotanoides L vor.Abkochung mit raffiniertem Wasser mit 360 mg/ml des ursprünglichen Arzneimittels.
- Nehmen Sie 50 ml, 100 ml und 150 ml C. abrotanoides L. verfeinerten Wassersud und verdünnen Sie sie, um Wasserabkochungen herzustellen, die 120 mg/ml, 240 mg/ml und 360 mg/ml der ursprünglichen medizinischen Materialien enthalten, jeweils 150 ml für den Standby-Modus.
HINWEIS: Während des Kochvorgangs sollte die Hitze gut kontrolliert werden. Nach dem Kochen wurde die Hitze reduziert und die Flüssigkeit auf 100 °C gehalten und leicht gekocht.
2. Vorbereitung der Mückenprobe
- Quelle der Mücken
- Sammlung von Ae. albopictus-Larven . In dieser Studie wurden die Larven von Ae. albopictus im August 2020 in der Wohngegend der Stadt Duyun (N: 26.25, E: 107.52) in der Provinz Guizhou gesammelt.
- Entsprechend der Verbreitung, der morphologischen Merkmale der Larven und adulten Tiere von Ae. albopictus ergab sich die Identifizierung von Aedes albopictus wie folgt: Die Basis von Ctenophora von Aedes albopictus-Larven hat eine feine Ausdehnung; unvollständiger Hecksattel; Der Beatmungsschlauch ist schwarz, kurz und dick; Die erwachsenen Tiere von Aedes albopictus sind kleine bis mittelgroße Mücken. Die weibliche Mücke ist mittelgroß und schwarz. Das mittelthorakale Scutellum hat einen weißen Längsstreifen, der sich in der Regel nach hinten hin allmählich verjüngt und sich im vorderen Bereich des kleinen Scutellums gabelt. Das Fußgelenk hat einen weißen Basisring, und das gesamte oder der größte Teil des Gelenks 5 ist weiß. Die Mücken wurden von den Lehrern für Parasitologie und Mückenspezialisierung an unseren Standorten als Ae. albopictus identifiziert.
- Halten Sie die konventionelle Fütterung bei einer Temperatur von 25 ± 1 °C und einer relativen Luftfeuchtigkeit von 70 % ± 10 % aufrecht und verwenden Sie eine 80-W-Leuchtstofflampe als Lichtquelle (hell: dunkel = 14 h:10 h).
- Füttern Sie die Larven mit Hühnerleberpulver und erwachsene Mücken mit 10 % Zuckerwasser.
- Sammeln von Mückeneiern
- Wenn die Larven von Ae. albopictus zu Puppen herangewachsen sind, saugen Sie die Puppen mit einer Einweg-Pasteurpipette aus Kunststoff aus und übertragen Sie sie in den Käfig der erwachsenen Mücke.
- Nach 3-5 Tagen des Schlüpfens der adulten Mücken paaren sich die weiblichen und männlichen Mücken. Füttern Sie zu diesem Zeitpunkt die weiblichen Mücken 4-8 Stunden lang mit Blut.
HINWEIS: Das mit Antikoagulans versetzte Blut wurde in eine Kulturschale gegeben, mit 37 °C warmem Wasser erhitzt und mit einer Schicht Mulltuch bedeckt, damit weibliche Mücken Blut saugen konnten. - Sammeln Sie die Eier von Aedes albopictus mit einem Eierauffangbecher (selbstgemacht: 300 ml gerader, undurchsichtiger Plastikbecher mit 250 ml destilliertem Wasser, und dann wurde das Filterpapier zur Hälfte um den inneren Rand des Bechers eingetaucht).
HINWEIS: Die Eier von Ae. albopictus können 3-6 Monate gelagert werden.
- Schlüpfen und Füttern von Mücken
- Während des Experiments schlüpfte Ae. albopictus in der Regel 1 Woche vor dem Experiment. Legen Sie die Eier von Aedes albopictus auf eine Emailleplatte, fügen Sie 1000 ml Leitungswasser hinzu und lassen Sie es länger als 24 Stunden stehen. Aus den Eiern schlüpfen in 1-2 Tagen Larven.
- Die Larven häuteten sich alle 1-2 Tage, d.h. sie nahmen um ein Stadium zu. Selektieren Sie 1000 Larven am Ende des dritten oder zu Beginn des vierten Stadiums, nachdem Sie 2-3 Generationen lang gezüchtet haben, ohne für den Test mit chemischen Insektiziden im Labor in Berührung zu kommen.
HINWEIS: Wenn die Dichte der Larven zu hoch ist, teilen Sie sie in Platten auf, damit die Larven normal wachsen können.
3. Nachweis der toxischen Wirkung von C. abrotanoides L. Abkochung auf Larven von Ae. albopictus durch die Tauchmethode
- Gruppierung festlegen
- Stellen Sie die Versuchsgruppe ein: Bereiten Sie C . abrotanoides L. Abkochungen (50 mL) mit drei Wirkstoffkonzentrationen (120 mg/ml, 240 mg/ml und 360 mg/ml) vor.
- Blanko-Kontrollgruppe: Verwenden Sie entchlortes Wasser (hausgemacht: Leitungswasser mit einer Standzeit von mehr als 24 Stunden) mit dem gleichen Volumen wie das Medikament.
- Positive Kontrollgruppe: Bereiten Sie das Medikament Deltamethrin, ein gängiges chemisches Insektizid, in einer Endkonzentration von 0,05 mg/ml vor.
- Zugabe von flüssigen Medikamenten
- Verwenden Sie mehrere Einweg-Plastikbecher mit einem Volumen von mehr als 200 ml und geben Sie 35 Ae. albopictus-Larven am Ende des dritten oder zu Beginn des vierten Stadiums zu 50 ml entchlortem Wasser.
- In der Versuchsgruppe 50 ml C. abrotanoides L. verfeinertes Wasser Desud jeder Konzentration hinzufügen, leicht schütteln und gleichmäßig mischen, um ein Gesamtvolumen von 100 ml zu erhalten. Die Endkonzentrationen der Abkochung von raffiniertem Wasser in C. abrotanoides L. betragen 60 mg/ml, 120 mg/ml und 180 mg/ml.
- Geben Sie in der Blindkontrollgruppe 50 mL entchlortes Wasser zu einem Gesamtvolumen von 100 mL hinzu und markieren Sie sie als Blindkontrolle.
- In der Positivkontrollgruppe werden 50 ml Deltamethrinlösung mit einer Konzentration von 0,1 mg/ml zugegeben, vorsichtig geschüttelt und gleichmäßig über ein Gesamtvolumen von 100 ml bis zu einer Endkonzentration von 0,05 mg/ml gemischt und als Positivkontrolle gekennzeichnet.
- Beobachtungen
- Bringen Sie die markierten Plastikbecher vorsichtig in den Beobachtungsraum mit der gleichen Fütterungsumgebung und notieren Sie den Tod von Ae. albopictus-Larven in jeder Versuchs- und Kontrollgruppe nach 12 Stunden, 24 Stunden, 36 Stunden bzw. 48 Stunden. Beobachten Sie die toten Individuen unter dem Mikroskop und vergleichen Sie sie mit den normalen Larven von Ae. albopictus .
- Wenn die Larven zum oben genannten Beobachtungszeitpunkt mit einer scharfen, feinen Nadel gerührt wurden und nicht entkommen konnten oder nicht reagierten, betrachten Sie sie als tot. Wiederholen Sie den Test dreimal.
HINWEIS: Wenn die Mortalität der Larven in der Kontrollgruppe 20 % überstieg, waren die Testergebnisse ungültig und mussten wiederholt werden. Der Gesamtansatz ist in Abbildung 2 zusammengefasst.
4. Simulationsexperiment im Freien
- Wenden Sie die drei Konzentrationen von C. abrotanoides L. Abkochung auf Ae. albopictus-Larven unter Freilandbedingungen an, um das Absterben der Larven zu beobachten. Vergleichen Sie, ob es einen Unterschied zwischen der toxischen Wirkung und der im Labor gibt.
- Wenden Sie die drei Konzentrationen von C. abrotanoides L. verfeinerter Wasserabkochung auf wilde Karausche unter Freilandbedingungen an, um zu beobachten, ob dies das Wachstum der Karausche beeinflusst. Damit soll vorläufig beurteilt werden, ob die C. abrotanoides L.Die Abkochung von raffiniertem Wasser schädigt die ökologische Umwelt.
HINWEIS: Die Konzentrationen entsprachen den in Schritt 3.2.2 genannten Konzentrationen. Die verwendeten Zeitpunkte sind 12 h, 24 h, 36 h bzw. 48 h. Die Wirkung des Feldsimulationsexperiments wurde durch den Vergleich der Mortalität von Ae. albopictus, die mit C . abrotanoides L. Abkochung behandelt wurden, unter Laborfütterungsbedingungen und natürlichen Bedingungen im Freien beurteilt.
5. Statistische Analyse
- Drücken Sie die quantitativen Daten im Mittelwert ± SD und die Zähldaten in Prozent (%) aus.
HINWEIS: Die hier verwendete statistische Inferenzmethode betrug p < 0,05, und die Differenz war statistisch signifikant. - Verwenden Sie geeignete Software für die statistische Analyse der Daten, und die Toxizitäten von drei verschiedenen Konzentrationen von C. abrotanoides L. decoction gegenüber Ae. albopictus-Larven wurden verwendet, um vorläufig zu bestimmen, welche Abkochkonzentration die beste Toxizität für Ae. albopictus-Larven aufwies.
Ergebnisse
Hier wurde ganzes Gras von C. abrotanoides L. in dieser Studie aus der Wildnis gesammelt (Abbildung 1). Nach der Identifizierung von C. abrotanoides L. wurde die Abkochung von C. abrotanoides L. nach der Abkochmethode (Abbildung 2) erhalten und in verschiedenen Konzentrationen (60 mg/ml, 120 mg/ml und 180 mg/ml) hergestellt. Es wurde auf Ae. albopictus-Larven mit der Larventauchmethode angewendet. Es wurde festgestellt, dass eine 24-stündige Behandlung mit 120 mg/ml C. abrotanoides L. Abkochung tote Larven schwarz machen konnte, und die Steifigkeit wurde durch morphologische Beurteilung beobachtet (Abbildung 3). Dann wurde die Mortalität der Larven nach der Behandlung mit unterschiedlichen Konzentrationen (60 mg/ml, 120 mg/ml und 180 mg/ml) Abkochung innerhalb einer Reihe von Zeitpunkten (12 h, 24 h, 36 h und 48 h) nachgewiesen. Es wurde festgestellt, dass eine 36-stündige Exposition gegenüber 120 mg/ml mehr als 90 % der Mücken töten kann. Carassius auratus Populationen wurden 36 h lang einer Abkochung von 120 mg/ml C. abrotanoides L. ausgesetzt, und sie waren nicht tot. Die Mortalitätsbewertung ergab, dass diese Konzentration kein schädliches Maß an ökologischer Umweltbelastung darstellt (Abbildung 4). Die medianen letalen Konzentrationen (LC50) von Ae. albopictus-Larven , die 24 h, 36 h und 48 h lang mit C. abrotanoides L. Abkochung behandelt wurden, betrugen 117,49 mg/ml, 83,09 mg/ml bzw. 73,34 mg/ml. Darüber hinaus nahm der LC50 mit zunehmender Behandlungszeit ab (Tabelle 1).

Abbildung 1: Die Fotos von der Sammelstelle für C. abrotanoides L.. Das ganze Gras von C. abrotanoides L. in dieser Studie wurde im April 2021 im Autonomen Kreis Sandu Shui in der Provinz Guizhou (N: 25,95, E: 107,87) gesammelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
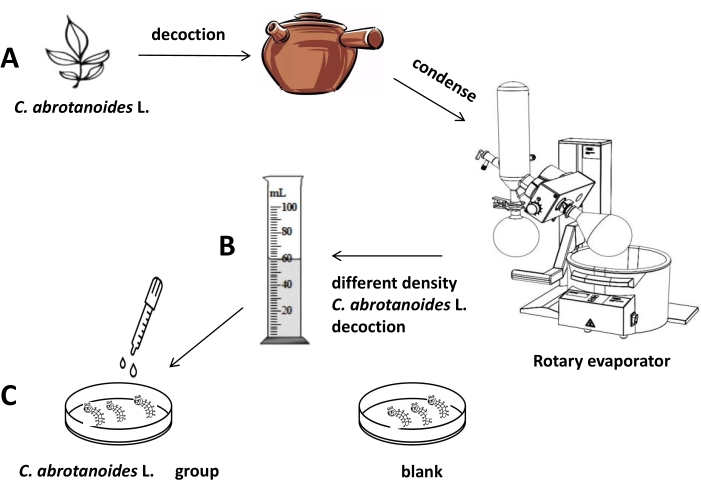
Abbildung 2: Flussdiagramm von C. abrotanoides L. Abkochung, die auf Ae. albopictus-Larven wirkt. (A) Die Entnahme und Identifizierung von C. abrotanoides L. und die Abkochung von C. abrotanoides L. erfolgten nach der Abkochmethode. (B) Konzentrationen von C. abrotanoides L. Abkochung (120 mg/ml, 240 mg/ml und 360 mg/ml). (C) Die Larven von Ae. albopictus wurden mit der Methode des Larventauchens behandelt und als blinde Kontrollgruppe eingesetzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
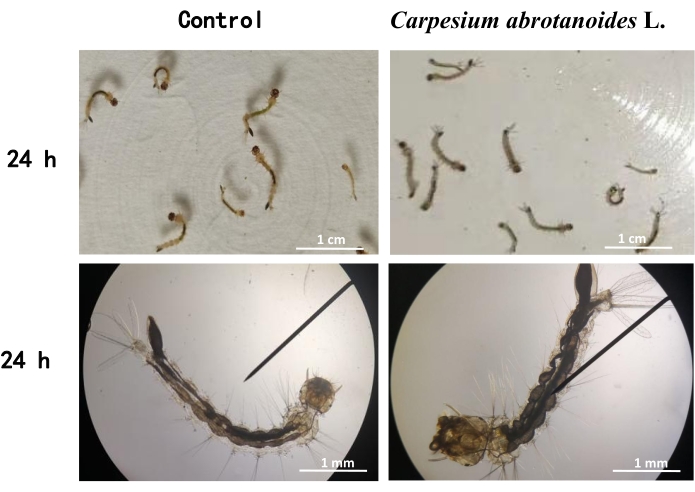
Abbildung 3: Normale und tote Larvenmorphologien von Ae. albopictus. C. abrotanoides L. decoction (120 mg/ml) wurde verwendet, um 24 Stunden lang auf Ae. albopictus-Larven einzuwirken. Bei der morphologischen Beurteilung waren die toten Larven schwarz und erschienen steif. Es wurde eine Blindkontrolle gesetzt, der keine zusätzliche Abkochung von C. abrotanoides L. zugesetzt wurde. Balken = 10x. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Toxische Wirkung von C. abrotanoides L. Abkochung auf Ae. albopictus-Larven . Die toxische Wirkung auf die Larve von Ae. albopictus wurde in Gegenwart von C. abrotanoides L. Abkochung (60 mg/ml, 120 mg/ml und 180 mg/ml) nach 12 h, 24 h, 36 h und 48 h untersucht. Jedes Experiment wurde in dreifacher Ausfertigung durchgeführt, und die Ergebnisse stellen den Mittelwert von drei Einzelexperimenten dar. Die Daten sind repräsentativ für ein Experiment mit mindestens drei unabhängigen biologischen Replikaten. Die Daten werden als Mittelwert ± SEM, n = 6, dargestellt. Die x-Achse zeigt den Zeitpunkt (h), zu dem die Larven von Ae. albopictus in Gegenwart von C. abrotanoides L. Abkochung untersucht wurden, und die y-Achse zeigt die Mortalität (%) von Ae. albopictus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Mückenstamm | Pflanzliches Insektizid | Zeitpunkt der Aktion (h) | LC50 (mg/L) |
| Ae. albopictus | C. abrotanoides L. Abkochung | 24 | 117.49 |
| 36 | 83.09 | ||
| 48 | 73.34 |
Tabelle 1: Die medianen letalen Konzentrationen (LC50) von Ae. albopictus-Larven , die mit C. abrotanoides L. Abkochung behandelt wurden. Die medianen letalen Konzentrationen (LC50) von Aedes albopictus-Larven , die 24 h, 36 h und 48 h lang mit C. abrotanoides L. behandelt wurden, betrugen 117,49 mg/ml, 83,09 mg/ml bzw. 73,34 mg/ml. Darüber hinaus nahm der LC50 mit zunehmender Behandlungszeit ab.
Diskussion
Derzeit gehört Ae. albopictus zu den 100 invasivsten Arten der Welt. Laut Statistiken der Weltgesundheitsorganisation (WHO) werden im Jahr 2020 die am stärksten von Ae. albopictus betroffenen Gebiete in Asien etwa 70 % der weltweiten Krankheitslast ausmachen12. Als lebenswichtiger Überträger von Dengue-Fieber, Gelbfieber und anderen durch Mücken übertragenen Krankheiten kann Ae. albopictus weltweit weit verbreitet sein und eine ernsthafte Bedrohung für die öffentliche Gesundheit darstellen. Hier kann die Entwicklung neuer botanischer Insektizide zur Kontrolle und Reduzierung von Ae. albopictus sicherere und umweltfreundlichere Optionen bieten. Daher wurde eine neue Methode zur Erzeugung botanischer Insektizide entwickelt, um die vergiftende Wirkung von C. abrotanoides L. zu untersuchen. an Ae. albopictus-Larven , um einen möglichen Pflanzenkandidaten zu liefern, der für die Entwicklung pflanzlicher Insektizide verwendet werden könnte.
Als traditionelles chinesisches pflanzliches Arzneimittel kann C. abrotanoides L. zur Behandlung von Blutergüssen und Fieber eingesetzt werden. Sein Extraktmaterial ist zudem umweltfreundlich und kann mit guter Sicherheit als pflanzliches Insektizid verwendet werden. Es wurde gezeigt, dass die Toxizität von C. abrotanoides L.-Extrakt für den Menschen gering war13,14. Der Grund für die Wahl der Abkochung von C. abrotanoides L. ist, dass die ersten drei Stadien von Ae. albopictus für Wachstum und Entwicklung im Wasser sein müssen, was eng mit seinem Lebenszyklus zusammenhängt. Die experimentellen Ergebnisse zeigen, dass die Abkochung von C. abrotanoides L. eine gute Vergiftungswirkung hat. Diese Art der Anwendung kann die Larven von Ae. albopictus vergiften und die Population der Ae. albopictus-Mücken wirksam bekämpfen. Daher wurden für das Forschungsziel Ae. albopictus-Larven ausgewählt, die eine repräsentative Art darstellen. C. abrotanoides L. Decud wurde zur Bekämpfung von Mückenlarven gewählt, um die ökologische Umgebung besser zu simulieren. Zweitens kann die Wirksamkeit der Substanz selbst auf natürliche Weise und ohne zusätzliche Modifikationen erhalten werden. Darüber hinaus zeigte die Kontrollgruppe, dass die Abkochung von C. abrotanoides L. für Carassius auratus-Populationen nicht giftig und umweltfreundlich war.
Für die Wahl der Methode wurden mehrere Konzentrationen von niedriger bis hoher Konzentration (60 mg/ml, 120 mg/ml und 180 mg/ml) durch Multiplikation der ursprünglich gewählten Konzentration festgelegt. Eine geeignetere Giftkonzentration kann in Versuchen im Feld gefunden werden. Darüber hinaus wurde gemäß der einschlägigen Literatur eine Reihe von Zeitpunkten (12 h, 24 h, 36 h und 48 h) gewählt. Für die Vergiftung von Ae. albopictus-Larven in freier Wildbahn muss die Zeit jedoch möglicherweise verlängert werden, um die Vergiftungswirkung besser beobachten zu können. Die Vergiftungswirkung von C. abrotanoides L. auf die Mortalität kann anhand der Mückenlarven und der Anzahl der adulten Eklosionen beurteilt werden.
Neben dem Sud von C. abrotanoides L. können Methanol, Ethylacetat und Petrolether verwendet werden, um die Wirkstoffe von C. abrotanoides L. zu extrahieren. Methanol ist ein hydrophiles organisches Lösungsmittel, und Ethylacetat und Petrolether sind lipophile organische Lösungsmittel. Die Arten von wirksamen Verbindungen, die durch jedes dieser Lösungsmittel extrahiert werden, sind unterschiedlich. Methanol extrahiert hauptsächlich Alkaloide, Ethylacetatextrakte, Flavonoide und Erdöletherextrakte, ätherische Öle und Sesquiterpene. Zum Beispiel berichtet die einschlägige Literatur, dass pflanzliche Sesquiterpenoide wirksame entzündungshemmende, antiparasitische, antitumorale und andere Arzneimittelwirkungen haben 15,16,17,18. Die aus C. abrotanoides L. isolierten Sesquiterpenoide haben eine starke Antimalariaaktivität gegen den Stamm Plasmodium falciparum D10, und ihre Aktivität gegen Parasiten ist mehr als zehnmal so hoch wie die von Säugetierzelllinien, so dass sie das Potenzial für große antiparasitäre Anwendungen und breite Anwendungsaussichten haben19. Terpenoide haben einen reichen Strukturtyp und vielfältige biologische Aktivitäten und haben einen wichtigen Anwendungswert für die Forschung und Entwicklung neuer Arzneimittel20,21. Neueste Forschungen haben ergeben, dass das ätherische Öl von Carpesium abrotanoides und seine Hauptbestandteile vor einem Dengue-Vektor, Ae. aegypti (Diptera: Culicidae), schützen können. Das ätherische Öl (EO) und seine Hauptbestandteile haben mückenabweisendes Potenzial22. Eine andere Studie ergab auch, dass EOs eine konzentrationsabhängige larvizide Wirkung auf Ae. aegypti-Larven hatten. Aromatische Verbindungen, die in EOs gefunden wurden, lösten eine signifikante Reaktion auf die Mortalität aus. EOs können als grünes Pestizid eingesetzt werden, um vektorübertragene Krankheiten wirksam zu bekämpfen23. Diese Erkenntnisse liefern neue Ideen für die Folgeforschung.
Hier liefern die Ergebnisse einen möglichen pflanzlichen Kandidaten, der für die Entwicklung pflanzlicher Insektizide verwendet werden könnte. Was die Einschränkungen dieser Methode betrifft, so wurde zunächst nur die toxische Abtötungswirkung von Wasserextrakt auf Ae. albopictus nachgewiesen, die zur Kontrolle der Anzahl der Ae. albopictus-Larven verwendet werden kann. Weitere Anstrengungen sind erforderlich, um kommerzielle Produkte zur Mückenbekämpfung zu entwickeln. Zweitens können bei der Herstellung des Abkochvorgangs von C. abrotanoides L. einige aktive Komponenten in C. abrotanoides L. mit der Verflüchtigung von Wasserdampf verloren gehen, was der Grund dafür sein kann, dass die in diesem Experiment beobachtete Mortalität niedriger war als in der tatsächlichen Situation. Schließlich befinden sich die Popularisierung und Anwendung dieser Methode noch im Stadium der kleinen Experimente. Wenn diese Methode zur Bekämpfung von Ae. albopictus nachweislich sehr zuverlässig ist; Es wird auf ein breiteres Verbreitungsgebiet und andere Mückenarten angewendet.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Wir danken Dr. Xin-Ru Wang von der University of Minnesota für ihre aufschlussreichen Vorschläge und Anleitungen. Diese Arbeit wurde durch den wissenschaftlichen Forschungsfonds des Qiannan Medical College for Nationalities (Qnyz202112, QNYZ202205) und den Wissenschafts- und Technologiefonds der Gesundheitskommission der Provinz Guizhou (qwjh [2022] Nr. 101, Projekt gzwkj2023-251) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetone (analytical purity) | Shanghai Shenbo Chemical Co., Ltd | ||
| Crucian carp | Guangzhou Yunfeng aquaculture Co., Ltd | ||
| Chicken liver powder | self made | ||
| Dechlorinated water | self made | The tap water standing for more than 24 hours | |
| Deltamethrin technical | Nanjing Lesheng Biotechnology Co., Ltd | Purity: 94.62% | |
| Disposable plastic cup | Guizhou Fuqiang technology Packaging Co., Ltd | 220ML-A1 | |
| Egg collecting cup | self made | ||
| Electric blast drying oven | Hangzhou Aipu Instrument Equipment Co., Ltd | WGLL-230BE | |
| Electric water distiller | Beijing Xinrun Kono Instrument Co., Ltd | TT-98-II | |
| GraphPad Prism | GraphPad Software | Data processing and graphics software | |
| Integrated digital microscope | Chongqing Aote Optical Instrument Co., Ltd | SMARTe-500 | |
| Mosquito feeding cage | Nanjing Lesheng Biotechnology Co., Ltd | custom made | |
| Multifunctional induction cooker | Guangdong Midea living appliance manufacturing Co., Ltd | C21-WK2102 | custom made |
| Qualitative filter paper | Hangzhou Fuyang Beimu pulp and Paper Co., Ltd | 15cm-102 | |
| Rotary evaporator | Henan Jingbang Instrument Equipment Co., Ltd | R-1010 | |
| Small crusher | Jinhua Mofei household appliances Co., Ltd | CHY-6001 | |
| SPSS Version 25.0 | IBM | statistical software | |
| Standard sample sieve | Hebei Hengshui Anping lvruo wire mesh products Co., Ltd | 100-30 | custom made |
| Sugar water,10% | self made |
Referenzen
- Hou, J., Liu, Q., Wang, J., Gong, Z. Insecticide resistance of Aedes albopictus in Zhejiang Province, China. Bioscience Trends. 14 (4), 248-254 (2020).
- Deng, J., Guo, Y., Su, X., Liu, S., Chen, X. G. Impact of deltamethrin- resistance in Aedes albopictus on its fitness cost and vector competence. PLoS Neglected Tropical Diseases. 15 (4), 0009391 (2021).
- Chebabi, A. G., David, R., Raimon, G., Salvador, Q., Nuria, G. Control of the asian tiger mosquito (Aedes albopictus) in a firmLy established area in spain: risk factors and people's involvement. Transactions of the Royal Society of Tropical Medicine and Hygiene. 107 (11), 706-714 (2013).
- Li, M. T., et al. The driving force for 2014 dengue outbreak in Guangdong, China. Plos One. 11 (11), 0166211 (2016).
- Wu, H. B., et al. Insecticidal activity of sesquiterpene lactones and monoterpenoid from the fruits of carpesium abrotanoides. JIndustrial Crops and Products. 92, 77-83 (2016).
- Mayur, B., Sandesh, S., Shruti, S., Sung-Yum, S. Antioxidant and α-glucosidase inhibitory properties of Carpesium abrotanoides L. Journal of Medicinal Plant Research. 4 (15), 1547-1553 (2010).
- Zhang, J. P., et al. The genus carpesium: a review of its ethnopharmacology, phytochemistry and pharmacology. Journal of Ethnopharmacology. 163, 173-191 (2015).
- Liu, X. Y., Guo, G. W., Wang, H. Killing effect of Carpesium abrotanoides on Taenia asiatica Cysticercus. Chinese Journal of Parasitology & Parasitic Disease. 33 (3), 237-238 (2015).
- Feng, X. Insecticidal activities of ethanol extracts from thirty chinese medicinal plants against spodoptera exigua (lepidoptera: noctuidae). Journal of Medicinal Plants Research. 6 (7), 1263-1267 (2012).
- Ma, Z., Zhang, X., Li, X., He, J. Activity evaluation of extracts from 99 plants against sitophilus zeamais. Journal of the Chinese Cereals & Oils Association. 28 (9), 103-108 (2013).
- Li, X. J., He, J., Feng, J. T., Ma, Z. Q., Zhang, X. Screening of the insecticidal activity of extracts from 106 plants in northwest area of China. Journal of Northwest A & F University (Natural Science Edition). 40 (11), 120-126 (2012).
- Jayarajah, U., Dissanayake, U., Edirisinghe, K., Seneviratne, P. The world health organization dengue case classifications). Galle Medical Journal. 25 (3), 74-79 (2020).
- Zhang, Z. L., Yang, T., Zhang, Y. K., Wang, L. H., Xie, Y. J. Fumigant toxicity of monoterpenes against fruitfly, drosophila melanogaster. Industrial Crops and Products. 81, 147-151 (2016).
- Roman, P. Essential oils for the development of eco-friendly mosquito larvicides: A review. Industrial Crops and Products. 76 (4), 174-187 (2015).
- Yang, Y. X., Shan, L., Liu, Q. X., Shen, Y. H., Zhang, W. D. Cheminform abstract: carpedilactones a-d, four new isomeric sesquiterpene lactone dimers with potent cytotoxicity from carpesium faberi. Organic Letters. 46 (7), 4216-4219 (2015).
- Chen, D. L., Li, X., Zhou, X. J. Research progress on sesquiterpenes and its pharmacological activities in genus carpesium. China Journal of Chinese Materia Medica. 45 (1), 37-51 (2020).
- Xu, D. D., et al. Sesquiterpenes and diterpenes with cytotoxic activities from the aerial parts of Carpesium humile. Fitoterapia. 128, 50-56 (2018).
- Tian, L., et al. Cle-10 from Carpesium abrotanoides L. suppresses the growth of human breast cancer cells (mda-mb-231) in vitro by inducing apoptosis and pro-death autophagy via the pi3k/akt/mtor signaling pathway. Molecules. 24 (6), 1091-1102 (2019).
- Kim, J. -. J., Chung, I. -. M., Jung, J. -. C. In vivo antiplasmodial activity of 11(13)-dehydroivaxillin from Carpesium ceruum. Journal of Enzyme Inhibition & Medicinal Chemistry. 24 (1), 247-250 (2009).
- He, Y. Q., Cai, L., Qian, Q. G., Yang, S. H., Zhou, X. J. Anti-influenza A (H1N1) viral and cytotoxic sesquiterpenes from Carpesium abrotanoides. Phytochemistry Letters. 35, 41-45 (2020).
- Zhang, L., Chen, F., Wang, J. Review on structural modifications, biological activities and structure-activity relationships of Parthenolide. Natural Product Research. 29, 1617-1620 (2017).
- Haris, A., Azeem, M., Binyameen, M. Mosquito repellent potential of carpesium abrotanoides essential oil and its main components against a dengue vector, Aedes aegypti (diptera: culicidae). Journal of Medical Entomology. 59 (3), 801-809 (2022).
- Hazarika, H., Tyagi, V., Kishor, S., Karmakar, S., Chattopadhyay, P. Toxicity of essential oils on Aedes aegypti: a vector of chikungunya and dengue fever. International Journal of Mosquito Research. 5 (3), 51-57 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten