Method Article
Isolierung und Identifizierung von mesenchymalen Stammzellen des Schweineknochenmarks und ihrer abgeleiteten extrazellulären Vesikel
In diesem Artikel
Zusammenfassung
In diesem Artikel wird eine Methode zur Isolierung und Identifizierung von mesenchymalen Stammzellen des Schweineknochenmarks (pBM-MSCs) und daraus abgeleiteten extrazellulären Vesikeln (EVs) entwickelt, die eine methodische Grundlage für die präklinische Bewertung der Transplantationswirksamkeit von BM-MSCs und ihren abgeleiteten EVs bietet.
Zusammenfassung
Mit der Entwicklung der Stammzelltherapie in der translationalen Forschung und regenerativen Medizin werden mesenchymale Stammzellen des Knochenmarks (BM-MSCs) als eine Art pluripotente Stammzellen aufgrund ihrer sofortigen Verfügbarkeit und nachgewiesenen Sicherheit bevorzugt. Es wurde berichtet, dass die Transplantation von BM-MSCs bei verschiedenen Krankheiten von großem Nutzen für die Reparatur von verletztem Gewebe ist, was mit der Modulation der Immun- und Entzündungsreaktionen über parakrine Mechanismen zusammenhängen könnte. Extrazelluläre Vesikel (EVs) mit einer doppelschichtigen Lipidmembranstruktur gelten als die Hauptmediatoren der parakrinen Wirkung von Stammzellen. EVs, die für ihre entscheidende Rolle bei der Zellkommunikation und epigenetischen Regulation bekannt sind, wurden bereits in vivo für die Immuntherapie eingesetzt. Ähnlich wie bei den mütterlichen Zellen befinden sich die meisten Studien zur Wirksamkeit der Transplantation von EVs jedoch immer noch auf der Ebene von Kleintieren, was nicht ausreicht, um wesentliche Beweise für die klinische Translation zu liefern. Hier verwenden wir die Dichtegradientenzentrifugation, um zunächst Knochenmarkzellen (BMC) aus Schweineknochenmark zu isolieren und anschließend durch Zellkultur Schweine-BM-MSCs (pBM-MSCs) zu erhalten, die durch die Ergebnisse der Beobachtung unter dem Mikroskop, des induzierten Differenzierungsassays und der Durchflusszytometrie identifiziert wurden. Darüber hinaus isolieren wir EVs, die von pBM-MSCs in Zellüberständen abgeleitet sind, durch Ultrazentrifugation, was mit den Techniken der Transmissionselektronenmikroskopie (TEM), der Nanopartikel-Tracking-Analyse (NTA) und des Western-Blottings erfolgreich bewiesen wurde. Insgesamt können pBM-MSCs und ihre abgeleiteten EVs durch die folgenden Protokolle isoliert und effektiv identifiziert werden, die in präklinischen Studien zur Transplantationswirksamkeit von BM-MSCs und ihren abgeleiteten EVs weit verbreitet sein könnten.
Einleitung
In den letzten 10 Jahren hat die Stammzelltherapie große Vorteile für Patienten versprochen, die an einer Vielzahl von Krankheiten und Verletzungen leiden, wie z. B. Traumata, Atemwegs- und Herz-Kreislauf-Erkrankungen. Mit den Fortschritten auf diesem Gebiet werden mesenchymale Stammzellen des Knochenmarks (BM-MSCs) von den Menschen allmählich wegen ihrer Zugänglichkeit und ihrer geringen ethischen Streitigkeitenbevorzugt 1, die trotz anderer Zelltypen als Goldstandard für die klinische Forschung gelten2. Therapien, die auf BM-MSCs basieren, sind auch für immer mehr Forscher attraktiv, da sie in der Lage sind, Immun- und Entzündungsreaktionen zu modulieren und verletztes Gewebe über Differenzierungs- oder parakrine Mechanismen zu reparieren3.
Extrazelluläre Vesikel (EVs), wie sie von der International Society for Extracellular Vesicles (ISEV) empfohlenwerden 4, beziehen sich auf die Gesamtheit der Partikel mit einer Lipiddoppelschichtstruktur, die auf natürliche Weise aus Zellen freigesetzt werden. Mit den jüngsten Entdeckungen verschiedener Inhaltsstoffe wie Proteine, Lipide und genetisches Material (z. B. miRNA, mRNA, DNA-Moleküle sowie lange nichtkodierende RNAs) in EVs aus verschiedenen Zelltypen5 wurde ihre entscheidende Rolle bei der Zellkommunikation und epigenetischen Regulation erkannt6. Als neuartiger Ersatz für mütterliche Zellen wurden EVs in der Immuntherapie und regenerativen Medizin mit Studien in vivo eingesetzt, die als Grundlage für die laufende präklinische Forschung und klinische Folgestudien dienen7.
Gegenwärtig befinden sich die meisten Studien zur Wirksamkeit der Transplantation von BM-MSC und daraus abgeleiteten EVs jedoch noch auf der Ebene von Kleintieren, was nicht ausreicht, um die notwendigen Nachweise für die klinische Translation zu erbringen. Daher ist es äußerst dringend, präklinische Forschung über die Transplantation von BM-MSC und daraus abgeleiteten EVs auf der Ebene von Großtieren wie Schweinen durchzuführen.
Es wurde berichtet, dass MSCs in extrem geringer Anzahl im Knochenmark vorhanden sind und nur 0,01 % bis 0,001 % der Gesamtzellen ausmachen8. Die präklinische Verabreichung von BM-MSCs erfordert jedoch eine große Anzahl von Zellen (≥10,7 pro Tier)9; Die Menge der benötigten EVs ist sogar noch größer, deren mittlere Dosis 0,25 mg Protein pro Kilogramm Körpergewicht bei Schweinenbeträgt 10. Um diese hohen Zahlen zu erreichen, besteht ein dringender Bedarf an einer sicheren und effektiven Methode zur Isolierung und Kultivierung von MSCs aus Schweineknochenmark, um ihre massive Expansion in vitro zu erreichen und ihre EVs mit hoher Proteinkonzentration anschließend zu gewinnen.
Bisher gibt es verschiedene Methoden, um BM-MSCs und ihre abgeleiteten EVs zu isolieren. Zu den aktuellen Methoden zur Isolierung von BM-MSCs gehören die direkte Pflanzung von Knochenmarkzellen (BMCs)11, die Dichtegradientenzentrifugation, die Sortierung molekularer Markierungen der Zelloberfläche und das Durchflusszytometrie-Screening. Es wurde berichtet, dass die Sortierung der molekularen Markierung der Zelloberfläche und das Durchflusszytometrie-Screening zu einer Abnahme der Zelladhäsionsrate, einer Erhöhung der 24-Stunden-Mortalität und einer Proliferationshemmung führen12, während die direkte Kultivierung von BMCs zu einer hohen Anzahl gemischter hämatopoetischer Zellen führen kann. Daher wird heute häufig die Dichtegradientenzentrifugation verwendet, um BM-MSCs zu erhalten. Zu den aktuellen Methoden zur Isolierung von EVs aus Zellüberständen gehören Ultrazentrifugation, Ultrafiltration, Polymerfällung und Größenausschluss13. Im Vergleich zu anderen Methoden hat die Ultrazentrifugation den Vorteil der geringen Kosten, der einfachen Handhabung und der Kompatibilität mit der Herstellung großer Volumina ohne komplizierte Vorbehandlung, was der "Goldstandard" für die EV-Trennung war14. Während des Prozesses besteht jedoch eine große Heterogenität bei den Reagenzien und Techniken in den verschiedenen Labors 3,15, was für die Leser irreführend sein könnte. In diesem Artikel wird eine Reihe von aufeinanderfolgenden Schritten zur Isolierung von pBM-MSCs und daraus abgeleiteten EVs im Detail erläutert, und die anschließenden Identifizierungsergebnisse beweisen, dass die Methode machbar ist, um pBM-MSCs und ihre EVs für die weitere Analyse in der präklinischen Forschung zu erhalten. Wir hoffen, dass diese systematische Arbeit eine methodische Grundlage für Forscher bieten kann, die sich mit der präklinischen Bewertung der Transplantation von pBM-MSCs und ihren abgeleiteten EVs befassen, damit klinische Studien so schnell wie möglich durchgeführt werden können.
Protokoll
Gemäß dem von den National Institutes of Health, USA, veröffentlichten Leitfaden für die Pflege und Verwendung von Labortieren wurden alle Versuchsverfahren vom Institutional Animal Care and Use Committee (IACUC) des Fuwai Hospitals der Chinesischen Akademie der Medizinischen Wissenschaften genehmigt.
1. Präoperative Vorbereitung der Tiere
- Besorgen Sie sich erwachsene männliche chinesische Minischweine (30 ± 5 kg) im Alter von etwa 12 Monaten vom Institut für Zoologie der Chinesischen Akademie der Wissenschaften und bringen Sie sie mindestens 2 Wochen im Voraus in den Einrichtungen des Tierversuchszentrums des Fuwai-Krankenhauses unter. Führen Sie präoperative Inspektionen durch, wie z. B. routinemäßige Blutuntersuchungen, um sicherzustellen, dass die Tiere gesund sind.
- Reinigen und rasieren Sie die Haut des Oberschenkelbereichs des Minischweins am Tag vor der Operation. Um eine Aspiration zu vermeiden, fasten Sie das Minischwein 12 Stunden lang, bevor Sie Knochenmarkentnahme vornehmen.
2. Vorbereitung für die Zellisolierung und -kultivierung
- Verwenden Sie Percoll (1.130 g/ml), um mesenchymale Stammzellen aus dem Knochenmark zu isolieren. Mischen Sie die Stammlösung mit 10x konzentriertem PBS im Verhältnis 9:1, um ein isotonisches Medium zu erhalten. Mischen Sie dann das isotonische Medium mit PBS im Verhältnis 3:2, um eine 60%ige Percoll-Lösung (1,077 g/ml) zu erhalten, die als endgültige Trennlösung zur Isolierung von pBM-MSCs verwendet werden kann.
- Bereiten Sie das modifizierte Dulbecco-Medium (IMDM) von Iscove mit 10 % fötalem Rinderserum und 1,0 % Penicillin-Streptomycin vor, um ein vollständiges Medium zu erhalten. Das gesamte Medium und PBS in einem 37 °C warmen Wasserbad für die anschließende Zellkultivierung vorwärmen.
3. Betäubung der Tiere
- Verabreichen Sie eine Vollnarkose mit Ketamin (10 mg/kg) und Xylazin (2 mg/kg) intramuskulär. Führen Sie die endotracheale Intubation schnell durch, wenn das Minischwein langsam atmet und weniger Gliedmaßenaktivität aufweist, und bewahren Sie die Spontanatmung, um eine fehlgeschlagene Intubation zu verhindern.
- Die Aufrechterhaltung der Anästhesie erfolgt durch Inhalation von 2 % Isofluran mit Sauerstoff (1,5 l/min) als Trägergas. Überwachen Sie während der Anästhesie die Herzfrequenz, die Atmung und die Blutsauerstoffsättigung des Minischweins in Echtzeit.
4. Entnahme von Knochenmark aus dem Minischwein
- Platzieren Sie das Minischwein in einer seitlichen Position. Um eine ausreichende Menge an Knochenmark für die nachfolgende Zellkultur zu gewährleisten, lokalisieren Sie die Knochenmarkpunktion am proximalen Femur des Minischweins (Abbildung 1). Desinfizieren und drapieren Sie die Haut des Einstichbereichs, bevor die Operation durchgeführt wird.
- Straffen Sie die Haut um die Punktionsstelle mit der nicht-dominanten Hand und stechen Sie die Knochenmarkbiopsienadel vertikal an der Stelle mit der dominanten Hand ein. Wenn Sie spüren, dass die Nadel mit dem kortikalen Knochen in Kontakt kommt, drehen Sie den Griff vorsichtig nach links und rechts, um die Nadel zu bohren. Wenn die Nadel in die Knochenmarkhöhle eindringt, besteht oft das Gefühl, den Widerstand zu verlieren.
- Nachdem die Punktion an Ort und Stelle ist, ziehen Sie die Kernnadel zurück. Befestigen Sie dann eine sterile 50-ml-Einwegspritze am Ende der Außennadel und spülen Sie die Innenwand der Spritze vorher mit Heparin aus.
- Entnehmen Sie langsam 20 mL Knochenmark und geben Sie sie vorsichtig in ein steriles 50 mL Zentrifugenröhrchen.
- Wenn der Vorgang abgeschlossen ist, ziehen Sie die Nadel heraus und entfernen Sie das Tuch. Desinfizieren Sie die Einstichstelle und drücken Sie sie 20 Minuten lang zur Blutstillung.
- Extubieren Sie das Minischwein, nachdem Sie die Spontanatmung wiederhergestellt haben. Wenn es vollständig wach ist und sich die Gliedmaßen frei bewegen können, bringen Sie das Minischwein in den Käfig zurück, um mit der Fütterung fortzufahren.
5. Isolierung mesenchymaler Stammzellen aus dem Knochenmark
- Geben Sie eine gleiche Menge vorgewärmtes PBS in das Knochenmark und mischen Sie sie gründlich. Verwenden Sie dann eine sterile Pipette, um 20 ml des verdünnten Knochenmarks oberhalb des Dichtegradientenlösungsniveaus von 60 % in einem Volumenverhältnis von 1:1 in ein steriles 50-ml-Zentrifugenröhrchen zu übertragen.
- Das Röhrchen bei 600 x g (Beschleunigung (ACC) = 5, Verzögerung (DEC) = 5) für 20 min bei Raumtemperatur (RT) zentrifugieren.
HINWEIS: Nach der Zentrifugation werden im Röhrchen vier Phasen gebildet, darunter die Serumphase, die mononukleäre Zellphase, die Dichtegradienten-Mittelphase und die Fällungsphase von oben nach unten. Die mononukleäre Zellphase ist eine dünne flockige Schicht zwischen dem Serum und dem Dichtegradientenmedium. In dieser Phase befinden sich mesenchymale Stammzellen, die aus dem Knochenmark gewonnen werden. - Ziehen Sie die mononukleäre Zellphase in ein steriles 15-ml-Zentrifugenröhrchen und waschen Sie es zweimal mit PBS bei 800 x g für 5 Minuten.
- Die gewaschenen Zellen werden in 2 ml vollständigem Medium resuspendiert und die resuspendierten Zellen in einen 175cm großen 2-Zell-Kulturkolben mit einer Dichte von 3-5 x 105/ml gepflanzt.
HINWEIS: Alle oben genannten Verfahren zur Isolierung mesenchymaler Stammzellen sind in Abbildung 2 zu sehen.
6. Kultivierung mesenchymaler Stammzellen in vitro
- Der Kulturkolben wird bei 37 °C in einer gesättigten, befeuchteten Atmosphäre mit 5 % CO2 inkubiert. Schütteln Sie den Kulturkolben alle 24 Stunden vorsichtig, um ein anhaftendes Wachstum der ausgefällten hämatopoetischen Stammzellen zu verhindern, und beobachten Sie das Zellwachstum, die Morphologie und die Kontamination unter einem Mikroskop.
- Tauschen Sie das Kulturmedium zum ersten Mal nach 3 Tagen aus und wechseln Sie dann das Medium alle 2-3 Tage. Wenn die Zellkolonien eine Konfluenz von 80 % bis 90 % erreichen, subkultivieren Sie die Zellen im Verhältnis 1:2.
7. Adipogene, osteogene und chondrogene Differenzierung von pBM-MSCs
- Adipogener Differenzierungsassay
- Bereiten Sie das adipogene Differenzierungsmedium A (Medium A) und B (Medium B) für BM-MSCs gemäß den Anweisungen des Kits vor. Spezifische Informationen zum Kit finden Sie in der Materialtabelle.
- Geben Sie 1 ml 0,1 % Gelatine in die Sechs-Well-Platte und schütteln Sie sie vorsichtig, damit der Boden jeder Vertiefung gleichmäßig bedeckt werden kann. Stellen Sie die Six-Well-Platte dann für mindestens 30 min in eine Reinbank oder einen CO2 -Inkubator.
- Nach 30 Minuten die Gelatine aspirieren und 2 ml allgemeines vollständiges Medium in jede Vertiefung geben. Anschließend werden die pBM-MSCs in die Sechs-Well-Platte mit einer Zelldichte von 2 x 104 Zellen/cm2 gepflanzt. Danach wird die Platte bei 37 °C in einer gesättigten Luftfeuchtigkeit von 5 % CO2 inkubiert.
- Wenn die Zellen eine Konfluenz von 100 % erreicht haben, entfernen Sie vorsichtig das gesamte Medium und geben Sie 2 ml Medium A in jede Vertiefung der Platte. Entfernen Sie nach 3 Tagen Medium A von der Platte und geben Sie 2 ml Medium B in jede Vertiefung.
- Entfernen Sie nach 1-tägiger Aufrechterhaltung Medium B und ersetzen Sie es durch Medium A zur Induktion. Nach dem Motto "Medium A für 3 Tage, Medium B für 1 Tag" verwenden Sie Medium A und B nacheinander für die Induktion.
- Beobachten Sie den Zellzustand während der Periode jeden Tag. Wenn die Zellen während des Induktionsprozesses von Medium A schrumpfen oder absterben, ersetzen Sie es rechtzeitig durch Medium B, bis sich der Zellzustand erholt hat.
- Wiederholen Sie den Induktions- und Erhaltungsvorgang und bereiten Sie sich auf die Färbung vor, wenn unter dem Mikroskop genügend Lipidtröpfchen geeigneter Größe beobachtet werden.
- Entfernen Sie das Medium für die adipogene Differenzierung in der Sechs-Well-Platte und waschen Sie es vorsichtig mit 1x PBS. Geben Sie 2 ml 4%ige Paraformaldehydlösung in jede Vertiefung und fixieren Sie sie 30 Minuten lang bei RT.
- Entfernen Sie das Paraformaldehyd-Fixiermittel und waschen Sie es zwei- bis dreimal mit 1x PBS, um sicherzustellen, dass das Fixiermittel gründlich entfernt wird. Geben Sie 2 mL Oil Red O Farbstoff in jede Vertiefung und färben Sie sie 30 Minuten lang bei RT.
- Entfernen Sie den Farbstoff Oil Red O und waschen Sie ihn zwei- bis dreimal mit 1x PBS. Geben Sie 2 ml 1x PBS in jede Vertiefung und beobachten Sie dann den Effekt der adipogenen Differenzierung unter einem Mikroskop.
- Osteogener Differenzierungsassay
- Bereiten Sie das komplette Medium für die osteogene Differenzierung gemäß den Anweisungen des Kits vor.
- Befolgen Sie die Schritte 7.1.2 bis 7.1.3, um pBM-MSC zu pflanzen und zu kultivieren.
- Wenn die Zellen eine Konfluenz von 70 % erreichen, entfernen Sie vorsichtig das allgemeine vollständige Medium und fügen Sie 2 ml Medium für die osteogene Differenzierung in jede Vertiefung der Platte hinzu.
- Wechsel auf frisches osteogenes Differenzierungsmedium alle 3 Tage. Setzen Sie die Induktion für 2-4 Wochen fort und bereiten Sie sich auf die Färbung mit Alizarinrot-Farbstoff vor, wenn während der Osteogenese offensichtliche Kalziumknötchen auftreten.
- Entfernen Sie das Medium für die osteogene Differenzierung in der Sechs-Well-Platte und waschen Sie es vorsichtig mit 1x PBS. Geben Sie 2 ml 4%ige Paraformaldehydlösung in jede Vertiefung und fixieren Sie sie 30 Minuten lang bei RT.
- Entfernen Sie das Paraformaldehyd-Fixiermittel und waschen Sie es zwei- bis dreimal mit 1x PBS, um sicherzustellen, dass das Fixiermittel gründlich gereinigt wird. Geben Sie 2 ml Alizarinrot-Farbstoff in jede Vertiefung und färben Sie sie 10 Minuten lang bei RT.
- Entfernen Sie den Farbstoff Alizarin Red und waschen Sie ihn zwei- bis dreimal mit 1x PBS. Geben Sie 2 ml 1x PBS in jede Vertiefung und beobachten Sie dann den Effekt der osteogenen Differenzierung unter einem Mikroskop.
- Chondrogener Differenzierungsassay
- Bereiten Sie die Vormischung für die chondrogene Differenzierung gemäß den Anweisungen des Kits vor.
- 3-4 x 105 pBM-MSC in ein steriles 15 mL Zentrifugenröhrchen überführen. Bei 250 x g für 4 min bei 20 °C zentrifugieren.
- Entfernen Sie den Überstand und fügen Sie 0,5 ml Vormischung hinzu, um das im vorherigen Schritt durch Zentrifugation erhaltene Pellet wieder zu suspendieren, und zentrifugieren Sie dann bei 150 x g für 5 min bei 20 °C. Wiederholen Sie diesen Schritt, um die Zellen erneut zu waschen.
- Bereiten Sie das komplette Medium für die chondrogene Differenzierung vor.
- Die im vorherigen Schritt erhaltene Zelle wird mit 0,5 mL vollständigem Medium resuspendiert und bei 150 x g für 5 min bei 20 °C zentrifugiert.
- Schrauben Sie die Kappe des Zentrifugenröhrchens ab, um den Gasaustausch zu erleichtern. Stellen Sie es aufrecht in einen Inkubator bei 37 °C, 5 % CO2 und gesättigter Luftfeuchtigkeit.
- Wenn die Zellen zu aggregieren scheinen (normalerweise nach 24-48 Stunden, abhängig von der tatsächlichen Situation), schnippen Sie mit dem Boden des Zentrifugenröhrchens, damit sich die Knorpelkugeln vom Boden lösen und im Medium schweben.
- Wechseln Sie alle 2-3 Tage zu frischem Alleinmedium für die chondrogene Differenzierung. Setzen Sie die Induktion fort, bis sich Knorpelkugeln mit einem Durchmesser von 1,5 bis 2 mm in der Röhre gebildet haben, und bereiten Sie dann die Abschnitte für die Färbung vor.
- Bereiten Sie Paraffinschnitte von Knorpelkugeln gemäß den Routineschritten pathologischer Experimente vor. Geben Sie Alicia Blue Farbstoff auf die entwachsten Abschnitte und färben Sie ihn 1 h lang bei 37 °C.
- Spülen Sie den Objektträger 5 Minuten lang mit fließendem Wasser ab und beobachten Sie dann die färbende Wirkung von Alicia Blue nach dem Trocknen unter dem Mikroskop.
8. Identifizierung des Zellphänotyps durch Durchflusszytometrie
- Wenn die Zellkolonien an den Passagen 3-5 eine Konfluenz von 80 % bis 90 % erreichen, entfernen Sie das Kulturmedium und waschen Sie die Zellen zweimal mit vorgewärmtem PBS. Anschließend werden die Zellen mit 3-4 ml 0,25 % Trypsin/EDTA verdaut und bei 37 °C in einer gesättigten befeuchteten Atmosphäre von 5 % CO2 für 2-3 min inkubiert, bis sie sich unter dem Mikroskop vom Boden des Kolbens lösen.
- Ernten Sie die Zellen mit einem 10 mL Vollmedium und überführen Sie die Zellsuspension in ein steriles 15 mL Zentrifugenröhrchen. Die Zellsuspension wird bei 800 x g 5 min lang bei RT zentrifugiert. Der Überstand wird verworfen und die Zellen werden mit 4 °C PBS gewaschen.
- Resuspendieren Sie die Zellen auf 10 mL mit 4 °C PBS. Die Zellsuspension ist in neun Gruppen mit einem Volumen von 1 ml in jedem 1,5-ml-Mikroröhrchen unterteilt, die als Negativkontrolle, FITC-Isotypkontrolle, PE-Isotypkontrolle, APC-Isotypkontrolle, CD105-, CD29-, CD90-, CD14- bzw. CD45-Gruppe bezeichnet werden. Stellen Sie sicher, dass die Anzahl der Zellen in jedem Mikroröhrchen zwischen 1 x 105 und 1 x 106 liegt.
- Die Suspension wird bei 800 x g für 5 min bei 4 °C zentrifugiert und die Zellen in jedem Mikroröhrchen erneut mit 100 μl 4 °C PBS resuspendiert. Mit Ausnahme der Negativkontrollgruppe werden 5 μl der entsprechenden Isotypkontrolle (FITC, PE und APC Maus IgG1 kappa Isotypkontrolle) und Antikörper (CD105, CD29, CD90, CD14 und CD45 monoklonale Antikörper) für die Durchflusszytometrie gemäß der Reihenfolge in Schritt 8.3 in jedes Mikroröhrchen gegeben. Vorsichtig mischen und 1,5 h bei 4 °C im Dunkeln inkubieren.
- Geben Sie 1 mL 4 °C PBS in jedes Mikroröhrchen und zentrifugieren Sie bei 300 x g für 10 min bei 4 °C. Verwerfen Sie den Überstand und fügen Sie 200 μl 4 °C PBS hinzu, um die Zellen wieder zu suspendieren.
- Nach dem Filtrieren der Zellsuspension16 werden mindestens 10.000 Zellen auf der Durchflusszytometrie getestet und die Daten mit der Durchflusszytometrie-Software analysiert.
9. Isolierung extrazellulärer Vesikel (EVs), die aus mesenchymalen Stammzellen des Schweinemarks gewonnen werden
- Wenn die pBM-MSCs-Konfluenz 80%-90% erreicht, verwerfen Sie den Überstand und waschen Sie die Zellen mit PBS 2x. Geben Sie dann 25 mL serumfreies IMDM in jeden Kulturkolben und inkubieren Sie 48 Stunden lang bei 37 °C in einer befeuchteten Atmosphäre von 5 % CO2 .
- Den Zellüberstand (konditioniertes Medium, CM) in ein 50-ml-Zentrifugenröhrchen geben und 10 min bei 4 °C bei 300 x g zentrifugieren, um die Zelltrümmer zu entfernen.
- Den Überstand wieder in ein weiteres 50-ml-Zentrifugenröhrchen auffangen. Die Isolierung der Elektrofahrzeuge ist so bald wie möglich nach der Entnahme des Überstands durchzuführen. Lagern Sie den Überstand für die Langzeitlagerung im Kühlschrank bei -80 °C, um den Verlust von Elektrofahrzeugen zu verhindern.
- Der Überstand wird in Schritt 9.3 bei 2.000 x g für 20 min bei 4 °C zentrifugiert.
- Der Überstand wird in ein steriles Röhrchen überführt, das für die Hochgeschwindigkeitszentrifuge und die Zentrifuge bei 16.500 x g für 30 min bei 4 °C verwendet wird.
- Der Überstand wird wieder in ein Ultrazentrifugenröhrchen überführt und bei 120.000 x g für mindestens 70 min bei 4 °C mit einem Festwinkelrotor zentrifugiert.
- Entsorgen Sie den Überstand vollständig. Geben Sie 1 mL 4 °C PBS in jedes Ultrazentrifugenröhrchen und resuspendieren Sie die Fällung mit einer Mikropipette. Mischen Sie die Lösung aus derselben Gruppe in ein Ultrazentrifugenröhrchen und fügen Sie dann 4 °C PBS hinzu, um das Volumen auf mehr als 3/4 des Röhrchens zu erhöhen.
- Bei 120.000 x g für 60 min bei 4 °C zentrifugieren und den Überstand so weit wie möglich entfernen.
- Resuspendieren Sie das Fällmittel erneut mit sterilem PBS und lagern Sie die EVs in einem -80 °C Kühlschrank.
HINWEIS: Die Menge an PBS für die Resuspendierung kann als 100 μl für die Ausfällung von jeweils zwei 175 cm2 Kulturflaschen bestimmt werden. Alle oben genannten Schritte zur Isolierung von Elektrofahrzeugen sind in Abbildung 3 systematisch dargestellt.
10. Identifizierung von EVs durch Transmissionselektronenmikroskopie (TEM), Nanopartikel-Tracking-Analyse (NTA) und Western Blotting
- Legen Sie die EV-Probe auf Eis, nachdem Sie sie in einem 25 °C heißen Wasserbad aufgetaut haben, und verdünnen Sie sie dann mit PBS auf die Hälfte der vorherigen Konzentration für den NTA-Nachweis17.
- Pipettieren Sie 10 μl der Probe auf das Kupfernetz, lassen Sie sie 1 Minute lang absetzen und absorbieren Sie die schwimmende Flüssigkeit mit Filterpapier. Geben Sie dann 10 μl Phosphowolframsäure in das Kupfernetz, lassen Sie es 1 Minute stehen und nehmen Sie die überschüssige Flüssigkeit auf.
- Nach einigen Minuten Trocknung bei RT ist eine elektronenmikroskopische Bildgebung unter der Bedingung einer Beschleunigungsspannung18 von 100 kV durchzuführen.
- Die EVs-Probe aus Schritt 9.9 wird in RIPA-Lysepuffer (25 mM Tris· HCl (pH 7,6), 150 mM Natriumchlorid [NaCl], 1 % Nonylphenoxypolyethoxylethanol (NP-40), 1 % Natriumdesoxycholat, 0,1 % Natriumdodecylsulfat (SDS), 1 mM Phenylmethansulfonylfluorid (PMSF), 1x Proteaseinhibitor) und weisen die Expression spezifischer Marker für EVs wie Alix, TSG101, CD81 und CD63 durch Western Blot19 nach.
Ergebnisse
Etablierung von mesenchymalen Stammzellen aus dem Schweineknochenmark
Mesenchymale Stammzellen, die aus dem Knochenmark von Schweinen gewonnen wurden, wurden erfolgreich isoliert und in vitro kultiviert, und die Morphologie der pBM-MSCs an verschiedenen Tagen ist in Abbildung 4 zu sehen. In der Primärkultur von pBM-MSCs zeigten mikroskopische Beobachtungen, dass die Zelladhärenz einen Tag nach der Pflanzung auftrat und die adhärenten Zellen in der Regel eine runde Form hatten. Die primären pBM-MSCs blieben in der Regel 3 Tage nach der Pflanzung in der Ruhephase, und die Zellproliferation begann am 4. Tag. Die Zellmorphologie änderte sich nach der Proliferation von rund zu spindelförmig, multilateral oder sternförmig, und die Zellkerne sind zentral, mit Doppelnukleolen in einigen Zellen. Die Zellkolonien wurden 7-9 Tage nach Beginn der Zellproliferation gebildet, und eine Zellkonfluenz von 80 % bis 90 % konnte nach 12 bis 14 Tagen erreicht werden. Die mikroskopische Beobachtung zeigte, dass die adhärenten Zellen als verstreute Kolonien wuchsen und in einem wirbelnden Muster angeordnet waren.
Die Zellproliferation wurde nach dem Passing signifikant beschleunigt, und in einer Woche konnte eine Konfluenz von 80 % bis 90 % erreicht werden. Die Zellmorphologie war ab dem zweiten Durchgang homogen spindelförmig, ähnlich wie bei Fibroblasten, mit einem Längen-Breiten-Verhältnis von etwa 2-3:1. Wenn die Zellen differenziert würden, könnten sie polygonal oder sternförmig erscheinen. Nach der Passage wuchsen die Zellen nicht mehr als verstreute Kolonien, sondern gleichmäßig und radial in paralleler Anordnung.
Identifizierung des Zelldifferenzierungspotenzials durch Färbung
Im adipogenen Differenzierungsassay zeigte die Ölrot-O-Färbung, dass runde orangerote Lipidtröpfchen unterschiedlicher Größe um den Zellkern herum auftraten (Abbildung 5A); Im osteogenen Differenzierungsassay zeigte die Alizarinrot-Färbung rote Knötchen auf der Zelloberfläche (Abbildung 5B), die durch die Farbreaktion mit Calciumsalzen verursacht wurden, die von Osteoblasten abgelagert wurden, die von pBM-MSCs differenziert wurden. Im chondrogenen Differenzierungsassay zeigte die Alicia-Blau-Färbung, dass der gesamte Gewebeschnitt blau war (Abbildung 5C), was durch die Färbung von endosauren Mucopolysacchariden in Knorpelkugeln verursacht wurde.
Identifizierung des Zellphänotyps durch Durchflusszytometrie
Es wurden Assays der Zelloberflächenmarker durchgeführt, um einen Phänotyp von pBM-MSCs zu erstellen. Aus den Ergebnissen der Durchflusszytometrie (Abbildung 6) geht hervor, dass drei positive Marker wie CD105, CD29 und CD90 signifikant auf der Oberfläche von pBM-MSCs exprimiert wurden, was 96,5 %, 99,8 % bzw. 92 % ausmachte (Abbildung 6A-C). Die Expression von CD14 und CD45 war jedoch negativ (Abbildung 6D,E). In der Zwischenzeit waren die Ergebnisse der entsprechenden Isotypkontrollen durchweg negativ, was in der Abbildung bereits überlagert wurde, was die Möglichkeit einer unspezifischen Bindung von Antikörpern ausschließt.
Identifizierung von EVs, die von pBM-MSCs abgeleitet sind, durch NTA, TEM und Western Blotting
Das Ergebnis der NTA zeigte, dass die mittlere Partikelgröße 126,9 nm betrug, was im Bereich von EVs lag; Außerdem betrug die ursprüngliche Konzentration der EVs-Probe 1,5 x 1010 Partikel/ml, und der genaue Wert, der der Größe zugewiesen wurde, ist in Abbildung 7A zu finden. Das Partikeltrajektoriendiagramm ist in Abbildung 7B dargestellt und zeigt, dass sich die Partikel in unregelmäßiger Brownscher Bewegung befanden. Des Weiteren war das diskoide Vesikel, wie die klassische Struktur von EVs, unter dem Elektronenmikroskop bei Vergrößerungen von 50.000x deutlich zu erkennen (Abbildung 7C). Auch die Expression spezifischer Marker für EVs wie Alix, TSG101, CD81 und CD63 wurde in der Probe durch Western Blot nachgewiesen (Abbildung 7D).

Abbildung 1: Einstichstelle des Knochenmarks des Minischweins. Der rote Bereich zeigt die Punktionsstelle der Knochenmarkentnahme, die sich am proximalen Femur des Minischweins befindet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Isolierung mesenchymaler Stammzellen aus Schweineknochenmark. Der Prozess der Isolierung mesenchymaler Stammzellen aus Schweineknochenmark ist im Flussdiagramm dargestellt, und vier flüssige Phasen sind nach der Dichtegradientenzentrifugation deutlich dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Isolierung von EVs, die von pBM-MSCs abgeleitet sind. Das schematische Diagramm zeigt spezifische Schritte zur Isolierung von EVs aus dem konditionierten Medium durch Ultrazentrifugation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Morphologische Merkmale von pBM-MSCs an verschiedenen Tagen. Ähnliche morphologische Eigenschaften von pBM-MSCs sind am 3., 5., 7. und 9. Tag nach der Pflanzung unter dem 100-fachen mikroskopischen Feld zu sehen, und am 9. Tag wurden Zellkolonien gebildet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5. Identifizierung des Differenzierungspotenzials von pBM-MSCs durch Färbung. (A) Adipogener, (B) osteogener und (C) chondrogener Differenzierungsassay von pBM-MSCs. Das Differenzierungspotenzial von pBM-MSCs kann anhand dieser Färbeergebnisse identifiziert werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
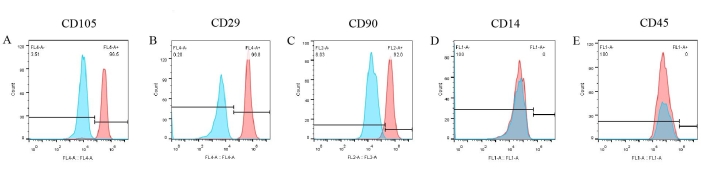
Abbildung 6: Identifizierungsergebnisse von pBM-MSCs mittels Durchflusszytometrie. CD105, CD29 und CD90 werden signifikant auf der Oberfläche von pBM-MSCs exprimiert und machen 96,5 %, 99,8 % bzw. 92,0 % aus, während die Expression von CD14 und CD45 negativ ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Identifizierungsergebnisse von EVs, die von pBM-MSCs abgeleitet wurden, durch Morphologie und Molekularbiologie. (A) NTA-Ergebnis von EVs, die von pBM-MSCs abgeleitet wurden, mit Partikelgrößenverteilungsdiagramm bzw. (B) Partikeltrajektoriendiagramm; (C) TEM-Bild, aufgenommen bei einer Vergrößerung von 50.000x, und der weiße Pfeil zeigt die klassische Struktur von diskoiden Vesikel. (D) Expression spezifischer Marker für EV durch Western Blotting. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die traditionelle Knochenmarkpunktion von Minischweinen wurde am Beckenkamm20 positioniert. Obwohl es leicht zu lokalisieren ist, ist die Menge der Knochenmarkentnahmeauf 21 begrenzt (nur etwa 5 ml im Allgemeinen), so dass es schwierig ist, die Anforderung einer großen Anzahl von Expansionen in vitro für die Transplantation in vivo zu erfüllen. Bei dieser Methode haben wir die Punktionsstelle des Knochenmarks an den proximalen Femur neu positioniert, und mindestens 20 ml Knochenmark können aus dieser Stelle entnommen werden, was eine ausreichende Menge an pBM-MSCs für die nachfolgende Zellkultur garantiert.
Die beiden wichtigsten Trennlösungen, die für die Isolierung von BM-MSCs durch Dichtegradientenzentrifugation verwendet werden, sind Percoll und Ficoll. Percoll besteht aus silikonisiertem Polyvinylpyrrolidon (PVP), einem neuartigen ungiftigen und nicht reizenden Zentrifugaltrennmittel mit Dichtegradienten. Die niedrige Diffusionskonstante von Percoll führt zu einem relativ stabilen Dichtegradienten; Daher kann eine zufriedenstellende Zelltrennung in der Regel innerhalb von zehn Minuten bei niedrigen Zentrifugalkräften (200-1000 x g) erreicht werden. Über die Methode zur Isolierung von pBM-MSC mittels Ficoll wurde bereits berichtet21. Im Vergleich zu Ficoll wurde Percoll aufgrund seiner Vorteile der leichten Isoperabilität, der niedrigen Viskosität, der Nichttoxizität und der Vermeidung von Zellaggregation, die die bestehenden Methoden zur Isolierung von pBM-MSCs ergänzen können, schrittweise eingesetzt.
Bei der Isolierung und Kultivierung von pBM-MSCs dürfen einige kritische Schritte nicht ignoriert werden. Erstens ist die erfolgreiche Schichtung verschiedener flüssiger Phasen nach der Dichtegradientenzentrifugation der Schlüssel zur Isolierung gereinigter pBM-MSCs. BM-MSCs haben als eine Art mononukleärer Knochenmarkzellen (BM-MNCs) ein ähnliches spezifisches Gewicht wie Lymphozyten und Monozyten, etwa 1,075 g/ml. Die ursprüngliche Dichte von Percoll beträgt 1,130 g/ml, und um die Zellschicht, die BM-MSCs enthält, nach der Dichtegradientenzentrifugation erfolgreich zu erhalten, muss eine 60%ige isotonische Dichtegradiententrennlösung (1,077 g/ml) im Voraus gemäß der Percoll-Dichte-Konzentrationsbeziehung22 konfiguriert werden. Darüber hinaus tragen auch geeignete Zentrifugationsbedingungen zu einer erfolgreichen Schichtung bei. Unter Berücksichtigung der niedrigen Diffusionskonstante von Percoll zentrifugierten wir das extrahierte Knochenmark bei 600 x g für 20 min bei relativ niedrigen Beschleunigungs-/Verzögerungswerten (ACC = 5, DEC = 5), was einen guten Schichtungseffekt erzielte. Zweitens ist auch für die Zellkultur eine angemessene Pflanzdichte unerlässlich. Um eine ausreichende Anzahl von MSCs (in der Regel mehr als 107 pro Tier9) für eine spätere Transplantation zu gewinnen, verwenden wir 175 cm2 Kulturflaschen für die Zellkultur. In einer vorangegangenen Studie20 wurden die gewonnenen BM-MNCs in der Regel in Kulturflaschen zur Kultivierung mit einer Dichte von 5 x 105/cm2 gepflanzt. Es wurde berichtet, dass nach Dichtegradientenzentrifugation 2-3 x 107 BM-MNCs pro 5 ml Schweineknochenmark erhalten werden können23. Daher empfehlen wir in diesem Protokoll, die Gesamt-BM-MNCs, die aus jedem 20-ml-Schweineknochenmark isoliert wurden, in einen 175cm großen 2-Kultur-Kolben zu pflanzen, um eine geeignete Dichte zu erreichen. Drittens sollten Verunreinigungen während der Isolierung und Kultivierung von pBM-MSCs vermieden werden. Bei der Entnahme der mononukleären Zellphase sollte die Pipette nicht in die Percoll-Phase eingeführt werden, um sich nicht mit der Trennflüssigkeit zu vermischen. Darüber hinaus sollte der Kulturkolben nach 24 Stunden Zelltransplantation vorsichtig geschüttelt werden, um die Adhärenz der roten Blutkörperchen zu verringern.
Während des Prozesses der Ultrazentrifugation beeinträchtigen hohe Konzentrationen von Proteinaggregaten und Lipoproteinkontaminationen durch diese Methode unweigerlich die Quantifizierung und funktionelle Analyse von EVs14. Um die Kontamination im Prozess so weit wie möglich zu reduzieren, sollte bei jedem Transfer des Überstands vor dem Ultrazentrifugationsschritt eine Flüssigkeitstiefe von 5 mm im Boden zurückgehalten werden. In der Zwischenzeit kann nach der ersten Ultrazentrifugation die Resuspendierung des Pellets in sterilem PBS und die anschließende erneute Durchführung der Ultrazentrifugation die Lipoproteinkontamination effektiv reduzieren.
Obwohl die Dichtegradientenzentrifugation und die Ultrazentrifugation bei der Isolierung von BM-MSCs bzw. ihren abgeleiteten EVs weit verbreitet sind, haben diese beiden Techniken auch ihre eigenen Grenzen. Einerseits ist die Percoll-Technik langwierig und umständlich, und die Gewinnung von BM-Konzentratproben über ein bettseitiges Zellkonzentrationsgerät wurde als alternative Methode zur Isolierung von MSCsberichtet 24. Auf der anderen Seite erfordert die Ultrazentrifugationsmethode nicht nur hochqualifizierte Techniker, sondern auch teure Geräte; Daher kann die kombinierte Anwendung von zwei oder mehr Techniken eine vernünftige Strategie für eine effizientere Isolierung von EVs25 darstellen. Darüber hinaus muss auch die Identifizierung von pBM-MSCs und ihren abgeleiteten EVs verbessert werden. Gemäß den internationalen Kriterien zur Definition von MSCs26 fehlt beispielsweise die Expression einiger positiver oder negativer Marker wie CD73, CD34 und HLA-DR in den Identifizierungsergebnissen von BM-MSC-Phänotypen durch Durchflusszytometrie in dieser Studie immer noch. Obwohl Maßnahmen ergriffen wurden, um eine Kontamination während des Prozesses der Isolierung von Elektrofahrzeugen zu vermeiden, sind wir aufgrund der Einschränkungen unseres Labors nicht in der Lage, die Reinheit der EV-Probe zu beurteilen, um die Nachverfolgungsarbeiten zu verbessern.
In dieser Studie werden Methoden zur sequentiellen Isolierung von pBM-MSCs und deren abgeleiteten EVs kombiniert, was durch die anschließenden Identifizierungsergebnisse systematisch belegt wird. Insbesondere haben wir die Schlüsseloperationen in dieser Reihe von Schritten hervorgehoben und einige spezifische experimentelle Bedingungen erläutert, die das Problem der Heterogenität, das in verschiedenen Laboratorien während dieses Prozesses besteht, bis zu einem gewissen Grad lösen können. Diese methodische Arbeit könnte in präklinischen Studien zur Transplantationswirksamkeit von BM-MSCs und ihren abgeleiteten EVs umfassend eingesetzt werden, was eine experimentelle Grundlage mit einem ausreichenden Niveau für die klinische Forschung bieten könnte.
Offenlegungen
Alle Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Wir danken Yang Jianzhong und Wang Xuemin für ihre Beiträge zur Knochenmarkentnahme. Diese Arbeit wurde durch Zuschüsse des CAMS Innovation Fund for Medical Sciences (CIFMS) [Fördernummer 2016-I2M-1-009] und der National Natural Science Foundation of China (Nr.: 82070307; Nr.: 81874461) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 175 cm2 cell culture flask | Thermo Fisher | 159910 | used for cell culture |
| 0.25% Trypsin/EDTA | Thermo Fisher | 25200056 | used to digest cells |
| Adipogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90031 | used for adipogenic differentiation assay |
| Alix Monoclonal Antibody | Thermo Fisher | MA1-83977 | used to identify extracellular vesicles(Evs) by western blotting |
| APC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 17-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| CD105 (Endoglin) Monoclonal Antibody | Thermo Fisher | 17-1057-42 | used to identify pBM-MSCs by flow cytometry |
| CD14 Monoclonal Antibody | Thermo Fisher | MA1-82074 | used to identify pBM-MSCs by flow cytometry |
| CD29/IGTB1 Monoclonal Antibody | Thermo Fisher | MA1-19458 | used to identify pBM-MSCs by flow cytometry |
| CD45 Monoclonal Antibody | Thermo Fisher | MA5-28383 | used to identify pBM-MSCs by flow cytometry |
| CD63 Monoclonal Antibody | Thermo Fisher | 10628D | used to identify EVs by western blotting |
| CD81 Monoclonal Antibody | Thermo Fisher | MA5-13548 | used to identify EVs by western blotting |
| CD90 Monoclonal Antibody | Thermo Fisher | A15794 | used to identify pBM-MSCs by flow cytometry |
| Chondrogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90041 | used for chondrogenic differentiation assay |
| Fetal Bovine Serum | Gibco | 10099141C | used to prepare complete medium |
| FITC Mouse IgG1 kappa Isotype Control | Thermo Fisher | 11-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Flow cytometry | BD | Accuri C6 | used for identification of cell phenotype |
| FlowJo software | BD | V10 | used to analyze data from flow cytometry |
| High-speed centrifuge tube (50 mL) | Beckman | 357003 | used for high-speed centrifugation |
| Iscove's Modified Dulbecco's Medium | Gibco | C12440500BT | used for cell culture |
| Low-temperature high-speed floor centrifuge | Avanti | J-26XPI | used for high-speed centrifugation to obtain clean conditioned medium |
| Nonyl phenoxypolyethoxylethanol (NP-40) | Sigma-Aldrich | NP40S | used for the composition of RIPA lysis buffer |
| Osteogenic Differentiation Kit for Bone Marrow Mesenchymal Stem Cell | OriCell | GUXMX-90021 | used for osteogenic differentiation assay |
| PE Mouse IgG1 kappa Isotype Control | Thermo Fisher | 12-4714-42 | used to eliminate the effects of non-specific staining in flow cytometry |
| Percoll | Cytiva | 17089102 | used to isolate porcine bone marrow mesenchymal stem cells(pBM-MSCs) |
| Phenylmethanesulfonyl fluoride (PMSF) | Thermo Scientific | 36978 | used for the composition of RIPA lysis buffer |
| Phosphate Buffered Saline(10x) | Beyotime | ST476 | used to prepare isotonic Percoll solution |
| Phosphate Buffered Saline(1x) | Cytiva | AF29561133 | used to dilute Percoll and wash cells |
| Protease inhibitor (1x) | Thermo Scientific | A32955 | used for the composition of RIPA lysis buffer |
| sodium chloride | Sigma-Aldrich | S9888 | used for the composition of RIPA lysis buffer |
| sodium deoxycholate | Sigma-Aldrich | D6750 | used for the composition of RIPA lysis buffer |
| sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | used for the composition of RIPA lysis buffer |
| Transmission electron microscopy | Hitachi | HT7700 | used for electron microscopy imaging |
| Tris·HCl | Sigma-Aldrich | 93363 | used for the composition of RIPA lysis buffer |
| TSG101 Monoclonal Antibody | Thermo Fisher | MA1-23296 | used to identify EVs by western blotting |
| Ultracentrifuge (Type 50.2 Ti Rotor) | Beckman | optima L-100XP | used for ultracentrifugation to isolate exosomes |
| Ultracentrifuge tube (26.3 mL) | Beckman | 355654 | used for ultracentrifugation |
| ZetaVIEW | Particle Metrix | S/N 17-310 | used for Nanoparticle Tracking Analysis |
Referenzen
- Heslop, J. A., et al. Concise review: workshop review: understanding and assessing the risks of stem cell-based therapies. Stem Cells Translational Medicine. 4 (4), 389-400 (2015).
- Berebichez-Fridman, R., Montero-Olvera, P. R. Sources and clinical applications of mesenchymal stem cells: State-of-the-art review. Sultan Qaboos University Medical Journal. 18 (3), 264-277 (2018).
- Antebi, B., Mohammadipoor, A., Batchinsky, A. I., Cancio, L. C. The promise of mesenchymal stem cell therapy for acute respiratory distress syndrome. The Journal of Trauma and Acute Care Surgery. 84 (1), 183-191 (2018).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnology Advances. 36 (1), 328-334 (2018).
- Lener, T., et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. Journal of Extracellular Vesicles. 4 (1), 30087(2015).
- Castro-Malaspina, H., et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 56 (2), 289-301 (1980).
- vander Spoel, T. I. G., et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease. Cardiovascular Research. 91 (4), 649-658 (2011).
- Gupta, D., Zickler, A. M., El Andaloussi, S. Dosing extracellular vesicles. Advanced Drug Delivery Reviews. 178, 113961(2021).
- Mareschi, K., et al. Multipotent mesenchymal stromal stem cell expansion by plating whole bone marrow at a low cellular density: a more advantageous method for clinical use. Stem Cells International. , 920581(2012).
- Van Vlasselaer, P., Falla, N., Snoeck, H., Mathieu, E. Characterization and purification of osteogenic cells from murine bone marrow by two-color cell sorting using anti-Sca-1 monoclonal antibody and wheat germ agglutinin. Blood. 84 (3), 753-763 (1994).
- Yang, D., et al. and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Willms, E., Cabañas, C., Mäger, I., Wood, M. J. A., Vader, P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Frontiers In Immunology. 9, 738(2018).
- Huang, P., et al. Combinatorial treatment of acute myocardial infarction using stem cells and their derived exosomes resulted in improved heart performance. Stem Cell Research & Therapy. 10 (1), 300(2019).
- Akbar, N., Pinnick, K. E., Paget, D., Choudhury, R. P. Isolation and characterization of human adipocyte-derived extracellular vesicles using filtration and ultracentrifugation. Journal of Visualized Experiments: JoVE. (170), e61979(2021).
- Jung, M. K., Mun, J. Y. Sample preparation and imaging of exosomes by transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56482(2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and characterization of microvesicles from peripheral blood. Journal of Visualized Experiments: JoVE. (119), e55057(2017).
- Yang, Y. J., et al. Atorvastatin treatment improves survival and effects of implanted mesenchymal stem cells in post-infarct swine hearts. European Heart Journal. 29 (12), 1578-1590 (2008).
- Lee, W. -J., et al. Isolation and cellular phenotyping of mesenchymal stem cells derived from synovial fluid and bone marrow of minipigs. Journal of Visualized Experiments: JoVE. (113), e54077(2016).
- Lindqvist, R. Food Microorganisms: Buoyant Density Centrifugation. Encyclopedia of Separation Science. Wilson, I. D. , Academic Press. 2843-2849 (2000).
- Yao, Y. L., Zhang, H., Gong, D. J., Song, Z. G., Xu, Z. Y. Transfecting hyperpolarization-activated cyclic nucleotide-gated channel 2 gene into porcine bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research. 13 (49), 9673-9676 (2009).
- Hegde, V., et al. A prospective comparison of 3 approved systems for autologous bone marrow concentration demonstrated nonequivalency in progenitor cell number and concentration. Journal of Orthopaedic Trauma. 28 (10), 591-598 (2014).
- Gallet, R., et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction. European Heart Journal. 38 (3), 201-211 (2017).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten