Method Article
Live-Fluoreszenz, inverse Bildgebung von Zellkräuseln und Macropinozytose
In diesem Artikel
Zusammenfassung
Dieses Protokoll demonstriert die Dextran-Bildgebung in lebenden Zellen unter Verwendung von kontinuierlicher Aufnahme und inversen Bildern, um die Visualisierung von Kräuselung, Makropinosomenreifung und Analyse von Dextran und anderen Zellmarkierungen zu optimieren.
Zusammenfassung
Die Macropinozytose ist ein hochkonservierter, aber noch unvollständig verstandener Prozess, der für die Aufnahme und Aufnahme von Flüssigkeit, Flüssigphasennährstoffen und anderem Material in Zellen unerlässlich ist. Die dramatische Ausdehnung von Zelloberflächenkräuseln, ihr Verschluss zu Makropinosomen und die Reifung internalisierter Makropinosomen sind Schlüsselereignisse in diesem Signalweg, die mit der herkömmlichen konfokalen Bildgebung, die auf der Verfolgung eines Bolus fluoreszierender Fracht basiert, schwierig zu erfassen sein können. Fluoreszierende Dextrane werden häufig experimentell als Flüssigphasenmarker für Makropinosomen und für andere endozytäre Signalwege verwendet. Eine Methode, die das Labor zur Optimierung der Bildgebung der Dextranaufnahme übernommen hat, besteht darin, die Live-Bildgebung von Zellen zu verwenden, die in hohen Konzentrationen von fluoreszierendem Dextran im Medium gebadet wurden, wobei die unmarkierten Zellen im Relief (als schwarz) erscheinen. Die Zellkräusel werden hervorgehoben, um den Kräuselungsverschluss sichtbar zu machen, und internalisierte Makropinosomen erscheinen als fluoreszierende Vakuolen im Zellinneren. Diese Methode ist optimal für die Visualisierung von Makropinosomenmerkmalen und ermöglicht eine einfache Segmentierung und Quantifizierung. In dieser Arbeit wird die duale Markierung von Signalwegen mit Dextranen unterschiedlicher Größe und die Co-Expression von Lipidsonden und fluoreszierenden Membranproteinen zur Markierung von Makropinosomen und anderen Endosomen beschrieben. Die Detektion von internalisiertem Dextran auf ultrastruktureller Ebene mittels korrelativer Licht- und Elektronenmikroskopie (CLEM) wird ebenfalls demonstriert. Diese Zellprozesse können mit mehreren Live-Bildgebungsmodalitäten abgebildet werden, auch in 3D. Zusammengenommen optimieren diese Ansätze die Makropinosomen-Bildgebung für viele verschiedene Umgebungen und experimentelle Systeme.
Einleitung
Die meisten Zelltypen von Wirbeltieren teilen die angeborene Fähigkeit zur nicht-selektiven Aufnahme von Flüssigkeit mit ihren Vorgängern im Laufe der Evolution, die auf einzellige Amöben zurückgehen1. Dieser hochkonservierte Prozess der Flüssigphasenaufnahme durch Makropinozytose (großes Trinken) wird von Amöben hauptsächlich zur Nährstoffaufnahme1 genutzt, während er in Wirbeltierzellen in ähnlicher Weise ein Versorgungsweg für die Gewinnung von Nährstoffen unter Stress sein kann, und er wird von Immunzellen zur Probenahme und Überwachung von Gewebeumgebungen verwendet2. Die Macropinozytose weist Merkmale auf, die sie von anderen Formen der Endozytose unterscheiden, einschließlich der charakteristischen, großen (>0,2 mm Durchmesser) vakuolären Makropinosomen, der nicht-selektiven Natur der Aufnahme von Flüssigkeit und gelösten Stoffen und der begleitenden Ausdehnungen der Plasmamembran, die opportunistisch in Makropinosomen internalisiert werden3. Die nicht-selektive Natur dieser Aufnahme bedeutet, dass die Sortierung und das Recycling schnell erfolgen müssen, um essentielle lösliche Proteine und Plasmamembranproteine zu retten, indem sie wieder an die Zelloberfläche zurückgeführt werden. Ein Großteil des Materials, das in Makropinosomen aufgenommen wird, ist für den Abbau in Lysosomen bestimmt und wird durch Makropinosomenreifung und Fusion mit anderen Endosomen in endo/lysosomale Wege geleitet. Plasmamembranproteine können auch aus Makropinosomen wieder an die Zelloberfläche zurückgeführt werden. Es besteht ein intensives Interesse auf dem Gebiet der Krebserkrankung, um den Prozess der Makropinozytose zu verstehen, die in Krebszellen aktiviert wird und dazu beiträgt, ihre Ernährung und Proliferation aufrechtzuerhalten 2,4,5,6. Die Macropinozytose tritt sowohl konstitutiv auf als auch kann durch Rezeptor-vermittelte Stimulation in Immunzellen weiter induziert werden, wo Makropinosomen die Rezeptorsignalisierung beherbergen, zur endo/lysosomalen Prozessierung der Antigenpräsentation beitragen und ein Eintrittsportal für eine Vielzahl von Viren, Bakterien und anderen Krankheitserregern darstellen 3,7.
Macropinosomen haben nur wenige markante oder einzigartige Marker. Sie sind am einfachsten während ihrer Bildung an der Basis dramatischer, aktinreicher Zelloberflächenkräuselungen zu identifizieren, die Flüssigkeitfast verschlingen 8. Unmittelbar nach dem Verschluss wird das F-Aktin um die Makropinosomen depolymerisiert, und die Makropinosomen selbst unterliegen dynamischen Veränderungen, die mit homo- und heterotypischer Fusion, Tubulation und Schrumpfung verbunden sind9. Macropinosomen sind auch auf ultrastruktureller Ebene schwer zu identifizieren, da sie keine charakteristischen Hüllen oder andere Merkmale aufweisen und lediglich als Vakuolen unterschiedlicher Größe erscheinen. Ohne definitive Membranmarker werden Makropinosomen am einfachsten und traditionellsten durch ihre flüssige Fracht definiert, die experimentell durch die Verwendung von fluoreszierendem Dextran erfolgt. Dextran ist ein von Glukose abgeleitetes komplexes Polysaccharid, das an eine große Anzahl von fluoreszierenden oder elektronendichten Markern gekoppelt und dem Medium zur Aufnahme durch Zellen zugesetzt oder zur Aufnahme in Gewebe perfundiert werden kann. Darüber hinaus wird Dextran mit hohem Molekulargewicht (MW) (70 kDa) heute als größenselektive Fracht für Makropinosomen angesehen, da es nicht in andere, kleinere endozytäre Vesikel eindringt, und es ist zur gebräuchlichsten Markierung für Makropinozytose geworden10,11. Bei der Betrachtung der Makropinozytose werden typischerweise Zellen mit einem Impuls aus fluoreszierendem Dextran inkubiert und fixierte oder lebende Zellen für die Fluoreszenzbildgebung verwendet, um den Bolus der Dextranmarkierung in Zellen in Makropinosomen zu betrachten. Aufgrund ihrer Größe können unmarkierte Makropinosomen in einigen Zelltypen auch mittels Phasenkontrast- oder Hellfeldmikroskopie betrachtet werden, wobei Makropinosomen als große weiße leere Vakuolen erscheinen. Aus den Phasenkontrastbildern der Zellen werden einige Kontextinformationen gewonnen, und diese Bilder können dann zusätzlich mit Fluoreszenzbildern überlagert werden, um die Aufnahme von fluoreszierendem Dextran darzustellen12,13. Dextrane unterschiedlicher Größe und mit unterschiedlichen Markierungen können zur Überwachung der Flüssigkeitsaufnahme in mehrere zelluläre und endozytäre Signalwege 10,14,15 verwendet werden, und Dextran kann auf Zellkulturen aufgetragen oder in Mäuse für die intravitale Bildgebungperfundiert werden 16 oder sogar in Fliegenembryonen17 für die Lebendbildgebung injiziert werden.
Zu den Schwierigkeiten bei der Verwendung von Dextran zur Verfolgung von Makropinosomen gehören sein Austritt aus Makropinosomen nach der Fixierung oder Permeabilisierung von Zellen, seine verdünnten oder schwer nachweisbaren Mengen in Zellen, die keine aggressive Makropinozytose durchführen, und seine dynamische Entfaltung und Dispersion in Zellen während der Makropinosomenreifung3. Diese Probleme werden in den meisten Experimenten verschärft, die darauf ausgelegt sind, die Aufnahme eines einzelnen Dextranimpulses zu verfolgen, der den Zellen zugesetzt und dann abgewaschen wird.
Stattdessen werden in dieser Arbeit die Vorteile des Auftragens von fluoreszierendem Dextran auf die Zellen und dessen Belassen im Medium während der Live-Bildgebung beschrieben, um eine kontinuierliche Aufnahme in die Zellen aufzuzeichnen. Dies verstärkt das Dextran-Signal in Makropinosomen und nachfolgenden Endosomen, die den gesamten Reifungsweg anzeigen. Betrachtet man markierte Makropinosomen vor dem unmarkierten (schwarzen) Inneren der Zellen, so zeigt sich in einer kontrastreichen inversen Einstellung alle Merkmale der Makropinosomen, und umgekehrt hebt das stark fluoreszierende Medium außerhalb der Zellen die dynamische Kräuselung der Zelloberfläche hervor. Diese Methode beschreibt die Live-Bildgebung von Dextran für lichtmikroskopische, konfokale Bildgebung und für dessen Detektion nach Zellfixierung durch korrelative Licht- und Elektronenmikroskopie (CLEM). Die hier enthaltene Bildgebung wurde an verschiedenen Zelltypen durchgeführt, um die breite Anwendbarkeit dieser Ansätze zu demonstrieren, einschließlich aktivierter Makrophagen und Mikrogliazellen, bei denen die Makropinozytose sehr aktiv und schnell ist, und bei Krebszellen, bei denen Makropinozytose relativ seltener vorkommt.
Protokoll
1. Vorbereitung der Zellen auf 35-mm-Glasbodenschalen (Tag 0)
- Zelllinien in vollständigem Medium, ergänzt mit 10 % hitzeinaktiviertem (für RAW264.7) oder normalem fötalem Kälberserum und 1 % L-Glutamin, bei 37 °C in befeuchtetem 5 % CO2 -Inkubator aufbewahren und passieren.
- Plattieren Sie die entsprechende Anzahl von Zellen, um eine Konfluenz von 60 % in 24 Stunden zu erreichen, auf 35-mm-Glasbodenschalen.
HINWEIS: Die empfohlene Zelldichte liegt zwischen 2 ml von 0,15 x 106 Zellen/ml bis 0,25 x 106 Zellen/ml für die hier beschriebenen Brustkrebszellen RAW264.7, BV2 Mikrogliazellen und MDA-MB 231.
2. Transfektion von Fluoreszenz-DNA-Plasmiden (Tag 1) - optional
HINWEIS: Verschiedene fluoreszenzmarkierte Proteine und Sonden können vorübergehend oder stabil in klonierten Zelllinien exprimiert werden, um spezifisch Aktin-Rüschen und Kompartimente im endozytären Signalweg zu markieren, wie z. B. frühe Endosomen, späte Endosomen oder Lysosomen.
- Transfizieren Sie die Zellen mit einem lipidbasierten Transfektionskit gemäß den Anweisungen des Herstellers, 1 Tag nach der Beschichtung in einer Gewebekulturhaube.
- 2 μg endotoxinfreies gereinigtes DNA-Plasmid in mindestens 125 μl essentiellem Medium (reduziertes Serum) verdünnen. Vorsichtig mischen und 5 min bei Raumtemperatur ziehen lassen.
- 5 μl Transfektionsmittel in mindestens 125 μl essentiellem Medium (reduziertes Serum) verdünnen. Vorsichtig mischen und 5 min bei Raumtemperatur ziehen lassen.
- Kombinieren Sie das verdünnte DNA-Plasmid und das verdünnte Transfektionsreagenz und inkubieren Sie weitere 10 Minuten, bevor Sie es tropfenweise in die Zellen geben.
- Inkubieren Sie die Zellen mit dem Transfektionskomplex bei 37 °C in einem befeuchteten 5%igen CO2-Inkubator für 3-4 Stunden, bevor Sie sie durch frisches Vollkulturmedium ersetzen.
- Verwenden Sie die transfizierten Zellen am nächsten Tag für Experimente oder unterziehen Sie sie einer Klonierung mit begrenzter Verdünnung, um stabil exprimierende Zelllinien zu erhalten.
3. Visualisierung von endozytären Vesikeln und Makropinosomen (Tag 2)
HINWEIS: Fluoreszierende Dextrane (Dextran Alexa Fluor 488/647 bei 10 kDa MW und Dextran Oregon Green 488/Tetramethylrhodamin bei 70 kDa MW, anionisch, Lysin fixierbar) mit unterschiedlichen Molekulargewichten werden verwendet, um die Aufnahme in die flüssige Phase in eine Reihe von endozytären Signalwegenzu überwachen 14. 70 kDa Dextran für Makropinosomen und 10 kDa für alle Signalwege.
- Bereiten Sie Dextran(e) als 2x konzentrierte Suspension bei 200-500 ng/ml in vorgewärmtem Kulturmedium für die Zugabe zu den Zellen vor.
- OPTIONAL: Experimente können eine vorherige oder gleichzeitige Zugabe von Nahrungsergänzungsmitteln oder Arzneimitteln erfordern, um die endozytäre Aktivität zu beeinflussen. Zum Beispiel werden Makrophagen und Mikrogliazellen mit Wachstumsfaktoren (z. B. 200 ng/ml CSF-1) oder aktivierenden Liganden (z. B. LPS 100 ng/ml oder 300 ng/ml CpG) vorbehandelt, um die Kräuselung und Makropinozytose zu verbessern. Kultivieren Sie die Krebszellen in einem geeigneten serumfreien Medium für 12-16 h, bevor Sie das Dextran in das vollständige Medium aufnehmen. Die empfohlene Zelldichte finden Sie in Schritt 1.2.
- Zur Vorbereitung der Live-Bildgebung positionieren Sie die in Glasbodenschalen gezüchteten Zellen auf dem Tisch eines inversen Konfokalmikroskops, das mit einem 37 °C warmen Heizkissen und einem 5 % CO2 -befeuchteten Inkubator ausgestattet ist.
- Das überschüssige Medium wird abgesaugt, wobei 500 μl des gesamten Mediums in der Glasbodenschale verbleiben.
- Finden Sie eine geeignete Zellregion und legen Sie den Fokus fest. Für die Zeitraffer-Bildgebung wählen Sie vor der Aufnahme die geeigneten Fluoreszenzlaser, Filter und Einstellungen vor. Verwenden Sie die folgenden Einstellungen, um einzelne Zellen und Makropinosomen aufzulösen.
- Nehmen Sie die Aufnahme des interessierenden Bereichs auf einem inversen konfokalen Mikroskop mit einem 63x 1,4 NA Ölimmersionsobjektiv von Plan Apochromat auf.
- Wählen Sie 512 x 512 für die Bildgröße, bidirektionales Scannen für schnelle Bildgebung.
- Fokussieren Sie sich auf eine einzelne Fokusebene der Zellen. Legen Sie diese Option so fest, dass sie als einzelne Schicht erfasst wird, oder stellen Sie eine optische Schichtdicke (Nyquist) von ca. 0,3 μm ein, um sie als Z-Stapel zu kombinieren.
- Wählen Sie einen Zeitraffer mit einem Intervall von 5 s für eine Dauer zwischen 20 und 45 Minuten, abhängig von den spezifischen Zelltypen.
- Wählen Sie den Hardware-Autofokus/die Fokusverfolgung, um die Bildstabilisierung während der Aufnahme für eine angemessene Dauer entsprechend den spezifischen Zellentypen zu unterstützen.
- Fügen Sie das gleiche Volumen von 2x Dextran-Spike-Medium hinzu und starten Sie sofort die Live-Bildaufnahme für Makrophagen. Warten Sie 20 Minuten, bevor Sie die langsamere Aufnahme in MDA-MB 231-Zellen abbilden.
HINWEIS: Mit dieser Methode wurden die BV2-Zellen mit zwei Fluorophorkanälen erfolgreich auf einer einzigen Ebene mit maximaler Geschwindigkeitsverfolgung kontinuierlich für 45 Minuten nach Zugabe des Dextran-Gemisches abgebildet. Um frühe Makropinosomen in RAW 264.7-Zellen zu erkennen, in denen die Makropinozytose sehr schnell erfolgt, nehmen Sie eine einzelne Schicht (für eine schnelle Bildgebung) oder einen Z-Stapel von 4-6 Schichten (für die 3D-Erfassung) auf und führen Sie einen Zeitraffer mit einem 5-s-Intervall für 20 Minuten nach Zugabe von Dextran durch. Erfassen Sie für MDA-MB 231-Zellen optimale Z-Stacks zwischen 10 und 15 Slices mit 5-s-Intervallen für 40 Minuten.
4. Korrelative Licht- und Elektronenmikroskopie (CLEM) (Tag 3) - Optional
- Bereiten Sie die Zellen gemäß den Schritten 1, 2 und 3 des Protokolls mit Anpassungen vor. Kurz gesagt, züchten Sie 0,2 x 106 Zellen/ml RAW264,7 Zellen auf gegrillten Glasbodenschalen (35 mm Schale, Nr. 1,5 gerastertes Deckglas, 14 mm Glasdurchmesser, unbeschichtet), transfizieren Sie es mit einem fluoreszierenden Plasmid (z. B. mCherry-2xFYVE) und lassen Sie es über Nacht vor der Zugabe von Dextran-488 (70 kDa) für 20 Minuten bei 37 °C, 5 % CO2 -Befeuchtungsbrutschrank stehen.
- Waschen Sie die Zellen schnell mit 1 ml eiskaltem PBS und fixieren Sie sie mit 0,1 % Glutaraldehyd.
- Erfassen Sie die fixierten Zellbilder des dextran-488 und mCherry-2xFYVE an einem konfokalen Mikroskop.
- Nehmen Sie Hellfeldbilder auf, um die Gitterpositionen zu identifizieren, bevor die Schüsseln für die Transmissionselektronenmikroskopie (EM) bearbeitet werden, wie zuvor beschrieben18. Kurz gesagt, fixieren Sie die Zellen in 2,5 % Glutaraldehyd, postfixieren Sie sie in 1 % reduziertem Osmiumtetroxid, färben Sie sie en-bloc mit 2 % Uranylacetat und dehydrieren Sie sie dann durch eine Reihe von Ethanol, bevor Sie sie in LX112-Harz einbetten. Schneiden Sie die gerasterten Stellen aus dem Block heraus und sammeln Sie ultradünne Schnitte mit einem Ultramikrotom. Nehmen Sie Bilder mit einem Elektronenmikroskop bei 80 kV mit geeigneter Software für Bildgebungssysteme auf.
5. Datenverarbeitung und Visualisierung (Tag 4)
HINWEIS: FIJI - ein Open-Source-Bildanalysepaket - wird für die Visualisierung und Analyseverwendet 33.
- Duplizieren Sie die Rohdaten für die Verarbeitung, um den F.A.I.R.-Datenprinzipien zu entsprechen, d. h. dass Forschungsdaten auffindbar, zugänglich, interoperabel und wiederverwendbar sind.
- Passen Sie die Helligkeit und den Kontrast für Bildsätze gleichermaßen anhand der Histogrammdaten an.
- Zeigen Sie die Bilder als Projektionen mit maximaler Intensität aus Z-Stapel-Bildern an, die erfasst wurden.
- Fügen Sie die Maßstabsleiste für Bildsätze ein.
- FOV-Daten zuschneiden/drehen (optional). Erstellen Sie repräsentative Panels für die Zeitreihendaten.
- Zur weiteren Analyse und Quantifizierung quantifizieren Sie die Fluoreszenzintensität von Dextran, das als Maß für die Makropinozytoseaktivität in die Zellen aufgenommen wird. Um die Analyse auf einzelne Zellen zu beschränken, verwenden Sie das hier beschriebene bildgebende Verfahren.
- Kehren Sie die LUT um, um die Farbe für Zellbereiche ohne Fluoreszenz umzukehren und so einen Schwellenwert durchzuführen.
- Segmentieren Sie das Vordergrundobjekt und erstellen Sie eine Zellmaske, um einzelne Zellen zu identifizieren.
- Verwenden Sie die Zellmaske in Verbindung mit einer zuvor veröffentlichten Methode19 , die einzelne Makropinosomen identifiziert und misst. Verwenden Sie diese Metriken, um die Makropinozytose zu quantifizieren, einschließlich Größe, Anzahl und Gesamtaufnahme pro Zelle.
Ergebnisse
Der Ansatz, unmarkierte lebende Zellen abzubilden, die in eine hohe Konzentration von fluoreszierendem Dextran getaucht sind, hat mehrere Vorteile gegenüber herkömmlichen bildgebenden Verfahren zur Verfolgung der Makropinozytose. Durch die Darstellung der Bilder im Relief erscheinen die Zellkörper schwarz und ermöglichen eine verbesserte Visualisierung der dramatischen Kräuselung der Zelloberfläche vor einem hellen, fluoreszierenden Hintergrund, gefolgt von der Fluidphaseninternalisierung von TMR-Dextran (70 kDa)-gefüllten Makropinosomen, wie in Abbildung 1A dargestellt. Bei dieser Projektion mit maximaler Intensität wird eine Krebszelle aufgenommen, wobei Makropinosomen von den kräuselnden Rändern in die Zellen eindringen. Das schwarze Innere der Zelle, ohne Hintergrund oder unscharfe Fluoreszenz, ermöglicht eine kontrastreiche Definition der Makropinosomen, die ihre Größe und Form genau darstellt und Veränderungen aufdeckt, die während der Reifung auftreten, wie in Abbildung 1B dargestellt und in Filmsequenzen in Abbildung 1C hervorgehoben. Die homotypische Fusion geht mit einer Zunahme der Größe einher (Abbildung 1C), und die Tubulation der Makropinosomen ist deutlich zu sehen (Abbildung 1D). Daher sind wir nun in der Lage, den Weg der flüssigen Fracht, die sich in Makropinosomen in die Zelle bewegt, und durch die aufeinanderfolgenden Reifungsschritte abzubilden. Durch die Live-Bildgebung sind keine chemischen Fixierungsschritte mehr erforderlich, die strukturelle Veränderungen an diesen Vesikeln verursachen können. Ein weiterer Vorteil besteht darin, dass die Laserintensitäten reduziert werden können und durch die Entlastung der zellulären Umrisse kein zusätzlicher Ganzzellmarker erforderlich ist.
In Abbildung 2 werden die Zellen in einem Gemisch aus zwei fluoreszierenden Dextranen, 647-Dextran (10 kDa) und 488-Dextran (70 kDa), als Flüssigphasenmarker gebadet. Das hell fluoreszierende Medium enthält sowohl Dextrans; Daher ist das Medium im zusammengefügten Bild gelb, und die Zellen enthalten Mischungen aus rot, grün und gelb markierten Endosomen. Der rote Kanal zeigt die Aufnahme in große Makropinosomen und in eine Reihe kleinerer Endosomen, von denen einige ein sehr helles 647-Dextran (10 kDa) aufweisen, was auf die Konzentration der Fracht in diesen Endosomen hinweist. Im grünen Kanal sind nur größere Makropinosomen markiert und durch 488-Dextran (70 kDa) als luminale Fracht unterschieden, die insbesondere die gleiche Intensität wie das extrazelluläre Medium hat, was auf das für Makropinozytose typische nicht-selektive Schlucken hinweist. Dieser Ansatz bietet sowohl die Möglichkeit, Makropinosomen zu identifizieren, als auch gleichzeitig andere Endosomen zum Vergleich anzuzeigen, und bietet das Potenzial, diese Signalwege und ihre Schnittpunkte zu quantifizieren.
In Abbildung 3 werden transfizierte Zellen verwendet, um fluoreszierende Zellmarker für Kontextinformationen in Zellen zu exprimieren, die eine Aufnahme von 488-Dextran (70 kDa) aus dem Medium durchlaufen. Fluoreszenzmarkierte Sonden werden hier verwendet, um Membranphospholipide während der Makropinozytose abzubilden. mCherry-PLCδ-PH ist ein Fusionsprotein der Pleckstrin-Homologiedomäne von PLCδ und des mCherry-Fluoreszenzproteins20, das eine spezifische Sonde für Phosphatidylinositol 4,5-bisphosphat (PI(4,5)P2) in der Plasmamembran ist (Abbildung 3A). mCherry-2xFYVE ist eine Sonde mit FYVE-Domäne, die spezifisch für Phosphatidylinositol-3-phosphat (PI3P) auf frühen Endosomenist 21 (Abbildung 3B).
In Abbildung 3A zeigt mCherry-PLCδ-PH eine Anreicherung von (PI(4,5)P2) auf Plasmamembrankräuseln bis zum Punkt des Makropinosomenschlusses. Es wird jedoch schnell von den Makropinosomen entfernt, die in die Zelle gelangen. Die Trennung von Dextran-gefüllten Makropinosomen bei der Internalisierung von den markierten Plasmamembranen ist in diesem Beispiel deutlich.
Wenn Dextran-gefüllte Makropinosomen weiter reifen und mit frühen Endosomen fusionieren, erhalten sie PI3P, das mit mCherry-2xFYVE umlaufend markiert werden kann, wie die korrelative Licht- und Elektronenmikroskopie (CLEM) zeigt, die die Möglichkeit bietet, markierte Kompartimente auf ultrastruktureller Ebene weiter zu untersuchen (Abbildung 3B). Das CLEM-Bild zeigt eine zweifarbige Fluoreszenz, die die ultrastrukturelle Ansicht der Zellen überlagert und eine kontextuelle Analyse der Endosomen und des Zellinneren ermöglicht. In dem hier abgebildeten Bild ist das mCherry-2xFYVE zu sehen, das mit Dextranen gefüllte Makropinosomen (M) umgibt, die bei EM als große leere Vakuolen erscheinen. Dieses Dextran hat noch keine späten Endosomen/Lysosomen (L) erreicht, die auf Fluoreszenzebene unmarkiert sind, aber durch EM gesehen und anhand ihrer intraluminalen Vesikel identifiziert werden können.
Ein weiteres Beispiel für die kombinierte Bildgebung von fluoreszenzmarkierten Frachten zeigt sich in BV2-Mikrogliazellen, die in serumfreiem Medium vorverhungert und dann gleichzeitig mit 647-Transferrin und 488-Dextran (70 kDa) behandelt wurden (Abbildung 4). 647-Transferrin bindet an Oberflächentransferrinrezeptoren, die internalisiert und vom Punktat22 zurück an die Oberfläche zurückgeführt werden. Die (roten) Recycling-Endosomen stehen im Kontrast zu den mit Dextran gefüllten Makropinosomen (grün), und diese können sogar für die mögliche Kreuzung der Signalwege zusammengeclustert gefunden werden. Diese Abbildung zeigt Live-Fluoreszenzbilder, die mit Hellfeldbildern überlagert werden, um Zellmerkmale zu betrachten. Macropinosomen sind in den Einschüben in Abbildung 4 als inverse Bilder dargestellt. Frames über einen Zeitverlauf von ~7 Minuten verfolgen die Internalisierung von Dextran-gefüllten Makropinosomen und ihre Bewegung von den Rüschen in die perinukleäre Region.

Abbildung 1: Verwendung von einfachem Fluorophor-konjugiertem Dextran und Lebendzell-Bildgebung mit negativem Relief zur Visualisierung der Makropinozytose. (A) MDA-MB 231-Zellen wurden 16 h lang in serumfreien Medien inkubiert und dann 20 Minuten lang mit TMR-Dextran 70 kDa MW in Vollmedien vorbehandelt, und dann wurde ein 40-minütiges Zeitraffervideo aufgenommen, um den Makropinosomen-Transport im Laufe der Zeit zu markieren und zu visualisieren. Repräsentative Projektionen der maximalen Intensität der Lebendzellmikroskopie zu einem einzigen Zeitpunkt sind in Rot und Lut-Grau dargestellt. Die gelben und rosa Kastenbereiche sind in C und D vergrößert, um aufeinanderfolgende Ereignisse der Makropinosomenfusion und -tubulation zu zeigen. (B) Schematische Darstellung der Abbildung von unmarkierten lebenden Zellen im Relief, die in fluoreszierendes Dextran getaucht sind, um die Flugbahn der Flüssigkeitsfracht zu verfolgen, die sich in die Zelle und durch den makropinozytären/endo/lysosomalen Weg bewegt. (C) Gelbe Einfügefelder und Pfeile markieren die Aufnahme von Dextranfracht in kleine Makropinosomen, die innerhalb der Zelle verschmelzen und an Größe zunehmen können. t' = 0 bezeichnet den Beginn dieses Segments, das sich auf die Fusion konzentriert und aus einem längeren Film extrahiert wurde. (D) Rosa Einsatzkästen und Pfeile markieren die Tubulation von Makropinosomen. t" = 0 bezeichnet den Beginn dieses Segments, das sich auf die Tubulation konzentriert, die aus einem längeren Film ausgewählt wurde. Maßstab: 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
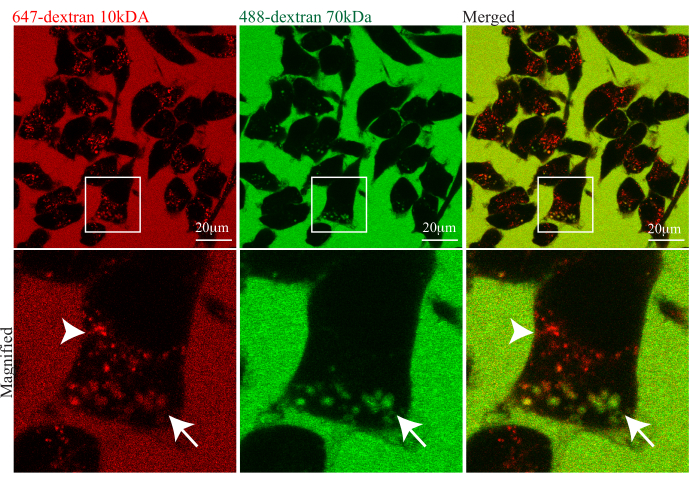
Abbildung 2: Verwendung von dualen Fluorophor-konjugierten Dextranen und Negativrelief-Lebendzell-Bildgebungsverfahren zur Unterscheidung des Transports in verschiedenen endozytären Signalwegen. BV2-Mikrogliazellen wurden in eine hohe Konzentration von zwei Dextranen (647-Dextran 10 kDA und 488-Dextran 70 kDa MW) getaucht und über die Zeit kontinuierlich abgebildet. Repräsentative Lebendzellbilder zeigen Makropinosomen, die grün oder gelb markiert sind, wenn sie sowohl 10 kDa als auch 70 kDa Dextran enthalten (wie durch den weißen Pfeil angezeigt), und andere kleinere Endosomen sind nur mit 10 kDa Dextran (rot) markiert (wie durch die weiße Pfeilspitze angezeigt). Die weißen Kästchen sind im unteren Bereich vergrößert, um die verschiedenen Populationen endozytärer Vesikel hervorzuheben. Maßstab: 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
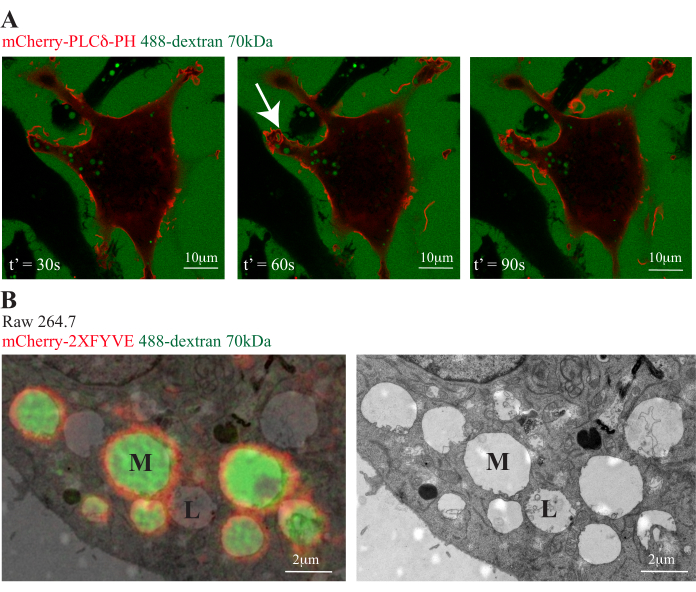
Abbildung 3: Verwendung zusätzlicher Fluoreszenzmarkierungen und Ultrastrukturanalyse. (A) RAW 264.7-Zellen wurden transient mit mCherry-PLCδ-PH transfiziert, um PI(4,5)P2 auf der Plasmamembran abzugrenzen. Repräsentative Lebendzellbilder zeigten, dass PI(4,5)P2 unter LPS-Stimulation an der Plasmamembran angereichert und zunächst zu Rüschen rekrutiert wird. Macropinosomen (grün markiert durch 488-70 kDa Dextran; weißer Pfeil) trennen sich von der Plasmamembran, wenn sie PI(4,5)P2 internalisieren und verlieren. t' zeigt den Zeitpunkt von aufwühlenden Ereignissen bis zur Aufnahme von Dextran in die Zelle. Maßstab: 10 μm. (B) Makrophagen wurden auf gegrillten Glasbodenschalen gezüchtet und mit mCherry-2xFYVE transfiziert, um PI3P in reifen Makropinosomen/frühen Endosomen zu markieren. 488-70 kDa Dextran wurde den Zellen 20 Minuten lang zugesetzt, bevor es mit 0,1 % Glutaraldehyd fixiert und mit konfokaler Mikroskopie abgebildet wurde, und dann wurden die Zellen mit Standardtechniken für die Transmissionselektronenmikroskopie bearbeitet. Die EM-Bilder wurden mit einer geeigneten Software für Bildgebungssysteme aufgenommen. CLEM-Bilder wurden manuell mit konfokalen Bildern kombiniert und ausgerichtet, um Fluoreszenzmarkierungen und ultrastrukturelle Merkmale gleichzeitig darzustellen. M: Makropinosom. L: spätes Endosom/Lysosom. Maßstabsleiste: 2μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Abbildung der Lebendaufnahme von Dextranen zusammen mit anderer fluoreszierender Fracht. BV2-Mikrogliazellen wurden vor der Behandlung mit einer molekularen Sonde, 647-Transferrin als Marker, um den Transferrinrezeptor der Zelloberfläche zu markieren und seinen Verlauf durch Recycling-Endosomen zu verfolgen, vorgehungert, um sie mit Makropinosomen zu vergleichen, die mit 488-70 kDa Dextran grün markiert wurden. t" stellt den Zeitpunkt dar, zu dem Bilder aus dem Zeitraffer aufgenommen wurden. Repräsentative Lebendzellbilder zeigten internalisierte 647-Transferrin-Cluster in punktförmigen Recycling-Endosomen (wie durch die weißen Pfeile angezeigt), von denen einige mit grünen Makropinosomen assoziiert sind. Die weißen Kästchen sind in den rechten Feldern vergrößert, um Details von Transferrinclustern an Makropinosomen darzustellen. Ein überlagerter Hellfeldkanal ermöglicht die Visualisierung von Membrankräuseln. Maßstabsleiste: 10μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Artikel werden Variationen traditioneller Methoden zur Verwendung der Dextran-Markierung zur Verfolgung der Makropinozytose beschrieben, basierend auf der Live-Bildgebung von Zellen, die kontinuierlich in fluoreszierenden Dextranen gebadet wurden, und der Visualisierung der Aufnahme von unmarkierten Zellen auf dem schwarzen Hintergrund. Das optimierte Protokoll bietet die Möglichkeit, zwischen verschiedenen intrazellulären Vesikeln zu unterscheiden und ermöglicht eine räumlich-zeitliche Verfolgung mehrerer makropinozytotischer und endozytärer Frachten und Proteine. Die Methode, Zellen in ein Dextranmedium einzutauchen, um den dynamischen Prozess der Flüssigphasenaufnahme zu überwachen, wurde erstmals in Dictyostelium23 demonstriert. Beispiele aus anderen früheren Studien haben auch Zellen im Relief betrachtet, um die Aufnahme zu sehen15,16. Das in diesem Artikel beschriebene Protokoll bietet eine umfassendere Behandlung und Analyse dieses Ansatzes, die nun zukünftige Studien in einer Vielzahl von Zell- und Gewebeumgebungen erleichtern wird. Dieser Ansatz ist auch für Organoide geeignet, die in Dextran gebadet wurden, und für In-vivo-Umgebungen, in denen Dextran normalerweise in Gewebe, Embryonen und ganze Organismen perfundiert oder injiziert wird, wo es nicht leicht ausgewaschen werden kann.
Die Aufnahme von kleinen und großen Dextransen, einzeln oder zusammen, kann eine leistungsfähige Grundlage für die Quantifizierung und den Vergleich der Makropinozytose mit anderen endozytären Signalwegen bieten. In doppelt markierten Proben können Populationen von Endosomen in rote und grüne Kanäle unterteilt oder zur Quantifizierung zusammengeführt werden. Die Quantifizierung kann unter Verwendung von Fidschi und einem bildbasierten Skript19 erreicht werden, das die Aufnahme von fluoreszierendem Dextran (oder die Aufnahme anderer Fluoreszenzmarker) pro Zelle misst (beschrieben im obigen Protokoll) für die Analyse einzelner Zellen und einer großen Anzahl von Zellen in ganzen Populationen. Mit dieser Methode können unterschiedliche, relative Messungen für Dextrane unterschiedlicher Farben und Größen innerhalb doppelt markierter Zellen erfasst werden, wie in Abbildung 2 dargestellt, um die unterschiedlichen Volumina und Verhaltensweisen der Aufnahme über makropinozytäre und endozytäre Wege aufzuzeichnen. Die Quantifizierung der Fluoreszenzintensitäten wird durch eine scharfe Abgrenzung von Makropinosomen und Endosomen vor dem kontrastreichen Hintergrund der schwarzen Zellen erleichtert.
Fluoreszierende Dextrane können auch mit einer Vielzahl anderer markierter Fracht- oder Membranproteine oder Lipide kombiniert werden, um Kontextinformationen für die Makropinozytose zu erhalten. Anhand von Beispielen von fluoreszierenden Lipidsonden zeigen wir, wie verschiedene Stadien der Makropinozytose definiert werden können. Darüber hinaus ist es auch möglich, mehrere Lipidsonden sowie Dextran zu kombinieren, um die dynamischen Übergänge von Phosphoinositiden während der Makropinozytose zu verfolgen24. Die Rolle sukzessiver Phospholipide im Prozess der Makropinozytose und für die Rezeptorsignalisierung und -sortierung innerhalb von Makropinosomen ist gut dokumentiert und kann auch mit Lipidkinase- und Phosphatase-Inhibitoren manipuliert werden 9,25,26. Ein weiterer wichtiger Ansatz besteht darin, die Aufnahme von Flüssigphasen-Dextran mit markierten Membranproteinen zu vergleichen, entweder um die Sonden innerhalb von Makropinosomen zu vergleichen oder um verschiedene Signalwege gegenüberzustellen, wie in Abbildung 4 gezeigt. Transferrin und Dextran können leicht und gleichzeitig auf Zellen appliziert werden, um die Internalisierung auf verschiedenen Wegen zu vergleichen. Markierte, membranassoziierte Rab-GTPasen können in Zellen exprimiert und zur Markierung verschiedener Stadien der Makropinozytose verwendet werden, einschließlich Rab8a, Rab13 und Rab5 19,24,27,28, während Rab7 und Lamp1 nützlich sind, um die Reifung von Makropinosomen bis hin zur Fusion mit späten Endo/Lysosomen zu verfolgen29,30.
Die Fähigkeit, Dextrane und andere fluoreszierende Marker für die Markierung auf ultrastruktureller Ebene umzuwandeln, wird aufgrund der Verfeinerung der CLEM-Techniken, einschließlich der Verfügbarkeit von gitterförmigen Deckgläsern zur Positionierung und Identifizierung von Zellen, immer häufiger. Große fluoreszierende Dextran-gefüllte Makropinosomen sind ideal für CLEM31, und Zellen können jederzeit nach der Pulsmarkierung mit Dextran oder nach der Live-Bildgebung von in Dextran gebadeten Zellen für die EM-Verarbeitung fixiert werden. Korrelative Techniken, die Fluoreszenz und scannende EM kombinieren, sind ebenfalls verfügbar und eignen sich besonders leistungsfähig für die Betrachtung von Zelloberflächenkräuseln32. Die Betrachtung der Zellultrastruktur ermöglicht eine weitere Charakterisierung von Endosomen anhand ihrer morphologischen Merkmale und Ereignisse wie homo- oder heterotypische Fusion, obwohl die Membrantubulation normalerweise durch Fixierung gestört wird.
Zusammenfassend lässt sich sagen, dass die Makropinozytose trotz ihrer alten Wurzeln und ihrer Prävalenz als zellulärer Signalweg immer noch unvollständig verstanden ist. Dextran und andere markierte Flüssigphasenladungen sind wichtige Werkzeuge für die Definition und Charakterisierung der Makropinozytose in einer Reihe von Zellen, Geweben und Organismen. Verbesserungen und Modifikationen in der Art und Weise, wie Dextran angewendet und seine Aufnahme abgebildet und quantifiziert werden kann, sind wichtig, um diesen Signalweg umfassend zu untersuchen und seine Überschneidung mit anderen zellulären Signalwegen und Organellen zu definieren. Die hier gezeigten Ansätze bieten Möglichkeiten, die Dextran-Bildgebung in lebenden Zellen zu optimieren.
Offenlegungen
Die Autoren erklären, dass keine konkurrierenden finanziellen Interessen bestehen.
Danksagungen
Die Autoren danken Tatiana Khromykh für ihre fachkundige technische Unterstützung. Die Fluoreszenzbildgebung wurde in der IMB-Mikroskopie unter Einbeziehung der von der Australian Cancer Research Foundation finanzierten Cancer Ultrastructure and Function Facility durchgeführt. Die Elektronenmikroskopie wurde im Zentrum für Mikroskopie und Mikroanalytik der UQ durchgeführt. Die Finanzierung erfolgte durch den National Health and Medical Research Council of Australia (JLS APP1176209) und den Australian Research Council (DP180101910). NDC wird als CZI Imaging Scientist mit der Fördernummer 2020-225648 von der Chan Zuckerberg Initiative DAF, einem beratenen Fonds der Silicon Valley Community Foundation, unterstützt. YH wurde durch ein Ph.D.-Stipendium der australischen Regierung und Finanzierung durch das Yulgilbar Alzheimer Research Program unterstützt. Z-JX wurde durch ein Stipendium der Chinesischen Akademie der Wissenschaften unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2% Osmium Tetroxide | ProSciTech | EMS19192 | |
| 647-Transferrin | Molecular Probes, Invitrogen | T23366 | |
| BV2 cells | Gift kindly given to us by Dr Liviu Bodea (Queensland Brain Institute) | - | |
| CpG (Class B) B | Integrated DNA Technologies | Custom Order | |
| Dextran Alexa Fluor 488 at 10 kDa MW | Life Technology Australia Pty Ltd | D22910 | |
| Dextran Alexa Fluor 647 at 10 kDa MW | Life Technology Australia Pty Ltd | D22914 | |
| Dextran Oregon Green 488 at 70 kDa MW | Life Technology Australia Pty Ltd | D1818 | |
| Dextran Tetramethylrhodamine at 70 kDa MW | Life Technology Australia Pty Ltd | D7173 | |
| DMEM medium with sodium pyruvate and L-glutamine | Gibco Invitrogen | #11995 | |
| Fetal Calf serum | Interpath Services Pty Ltd | SFBS-F | |
| Glutaraldehyde aqueous solution, EM Grade 25% | ProSciTech | C002 | |
| Jeol 1011 electron microscope | JEOL | - | |
| L-Glutamine | Gibco Invitrogen | 25030081 | |
| Lipofectamine 2000 | Gibco Invitrogen | 11668019 | |
| MatTek Glass Bottom Dish 35 mm, uncoated grid | MatTek Corporation | P35G-2-14-CGRD | |
| MatTek glass bottom dishes 35 mm uncoated | MatTek Corporation | P35G-1.5-14C | |
| MDA-MB 231 cells | ATCC | HTB-26 | |
| Opti-MEM reduced serum medium | Thermo Fisher Scientific | 31985088 | |
| Plasmid mCherry-2XFYVE | Gift kindly given to us by Dr Frederic Meunier (University of Queensland) | - | |
| Plasmid mCherry-PLCδ-PH | Gift kindly given to us by Dr Frederic Meunier (University of Queensland) | - | |
| Raw264.7 cells | ATCC | TIB-71 | |
| RPMI medium 1640,without L-glutamine | Gibco Invitrogen | #21870 | |
| Ultrapure LPS | Jomar Life Research Pte Ltd | TLR-3PELPS | |
| Uranyl Acetate | ProSciTech | C079 | |
| Zeiss inverted LSM880 confocal microscope | Zeiss | - |
Referenzen
- King, J. S., Kay, R. R. The origins and evolution of macropinocytosis. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 374 (1765), 20180158 (2019).
- Stow, J. L., Hung, Y., Wall, A. A. Macropinocytosis: Insights from immunology and cancer. Current Opinion in Cell Biology. 65, 131-140 (2020).
- Kerr, M. C., Teasdale, R. D. Defining macropinocytosis. Traffic. 10 (4), 364-371 (2009).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: A metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology (Lausanne). 8, 261 (2017).
- Stow, J. L., Condon, N. D. The cell surface environment for pathogen recognition and entry. Clinical & Translational Immunology. 5 (4), 71 (2016).
- Swanson, J. A., Watts, C. Macropinocytosis. Trends in Cell Biology. 5 (11), 424-428 (1995).
- Buckley, C. M., King, J. S. Drinking problems: mechanisms of macropinosome formation and maturation. FEBS Journal. 284 (22), 3778-3790 (2017).
- Berthiaume, E. P., Medina, C., Swanson, J. A. Molecular size-fractionation during endocytosis in macrophages. Journal of Cell Biology. 129 (4), 989-998 (1995).
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: Similarities and differences. Membranes (Basel). 10 (8), 177 (2020).
- Pacitto, R., Gaeta, I., Swanson, J. A., Yoshida, S. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages. Journal of Leukocyte Biology. 101 (3), 683-692 (2017).
- Yoshida, S., Pacitto, R., Yao, Y., Inoki, K., Swanson, J. A. Growth factor signaling to mTORC1 by amino acid-laden macropinosomes. Journal of Cell Biology. 211 (1), 159-172 (2015).
- Chvanov, M., et al. Intracellular rupture, exocytosis and actin interaction of endocytic vacuoles in pancreatic acinar cells: initiating events in acute pancreatitis. Journal of Physiology. 596 (13), 2547-2564 (2018).
- Ballesteros, A., Swartz, K. J. Dextran labeling and uptake in live and functional murine cochlear hair cells. Journal of Visualized Experiments: JoVE. (156), e60769 (2020).
- Weigert, R. Imaging the dynamics of endocytosis in live mammalian tissues. Cold Spring Harbor Perspectives in Biology. 6 (4), 017012 (2014).
- Chen, L., et al. A novel method to image macropinocytosis in vivo. Frontiers in Neuroscience. 12, 324 (2018).
- King, N. P., et al. Soluble NSF attachment protein receptor molecular mimicry by a Legionella pneumophila Dot/Icm effector. Cellular Microbiology. 17 (6), 767-784 (2015).
- Condon, N. D., et al. Macropinosome formation by tent pole ruffling in macrophages. Journal of Cell Biology. 217 (11), 3873-3885 (2018).
- Lemmon, M. A. Pleckstrin homology (PH) domains and phosphoinositides. Biochemical Society Symposium. 74, 81-93 (2007).
- Gillooly, D. J., et al. Localization of phosphatidylinositol 3-phosphate in yeast and mammalian cells. EMBO Journal. 19 (17), 4577-4588 (2000).
- Mayle, K. M., Le, A. M., Kamei, D. T. The intracellular trafficking pathway of transferrin. Biochimica et Biophysica Acta. 1820 (3), 264-281 (2012).
- Hacker, U., Albrecht, R., Maniak, M. Fluid-phase uptake by macropinocytosis in Dictyostelium. Journal of Cell Science. 110, 105-112 (1997).
- Wall, A. A., et al. Small GTPase Rab8a-recruited Phosphatidylinositol 3-Kinase gamma regulates signaling and cytokine outputs from endosomal toll-like receptors. Journal of Biological Chemistry. 292 (11), 4411-4422 (2017).
- Bohdanowicz, M., Grinstein, S. Role of phospholipids in endocytosis, phagocytosis, and macropinocytosis. Physiological Reviews. 93 (1), 69-106 (2013).
- Swanson, J. A., Yoshida, S. Macropinosomes as units of signal transduction. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 374 (1765), 20180157 (2019).
- Schnatwinkel, C., et al. The Rab5 effector Rabankyrin-5 regulates and coordinates different endocytic mechanisms. PLoS Biology. 2 (9), 261 (2004).
- Yeo, J. C., Wall, A. A., Luo, L., Stow, J. L. Sequential recruitment of Rab GTPases during early stages of phagocytosis. Cellular Logistics. 6 (1), 1140615 (2016).
- Racoosin, E. L., Swanson, J. A. Macropinosome maturation and fusion with tubular lysosomes in macrophages. Journal of Cell Biology. 121 (5), 1011-1020 (1993).
- Dolat, L., Spiliotis, E. T. Septins promote macropinosome maturation and traffic to the lysosome by facilitating membrane fusion. Journal of Cell Biology. 214 (5), 517-527 (2016).
- Kuhn, S., Lopez-Montero, N., Chang, Y. Y., Sartori-Rupp, A., Enninga, J. Imaging macropinosomes during Shigella infections. Methods. , 12-22 (2017).
- Kommnick, C., Lepper, A., Hensel, M. Correlative light and scanning electron microscopy (CLSEM) for analysis of bacterial infection of polarized epithelial cells. Scientific Reports. 9 (1), 17079 (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten