Method Article
用于多重测定的颅神经嵴细胞三维 体外 分化方案
摘要
我们提出了一种三维 (3D) 体外 分化方案,生成可重复大小的神经球,以从小鼠胚胎干细胞产生颅神经嵴细胞。我们表明,与以前的方案相比,这种方法减少了可变性,以及它如何用于多路检测以研究颅神经嵴细胞发育。
摘要
凭借其产生外胚层和间充质衍生物的非凡能力,颅神经嵴细胞 (CNCC) 在研究调节细胞命运决定和可塑性的机制方面引起了广泛的兴趣。该细胞群起源于背神经上皮,是短暂的,在发育中的胚胎中相对罕见 - 这使得功能测试、基因组筛选和生化测定难以 在体内进行。为了克服这些限制,已经开发了几种方法来模拟体外 CNCC 的发展 。 基于神经球 (NS) 的培养方法提供了一个复杂的微环境,以 3D 形式概括了发育中的前神经上皮。这些系统允许在同一板中生长许多 NS 以产生大量 CNCC,但产生的 NS 在形状、大小和形成的 CNCC 数量上表现出高度可变性 - 使得定量分析难以进行。该方案概述了一种从 96 孔格式的小鼠胚胎干细胞 (mESC) 生成 NS 的可重复方法。在 96 孔板中产生的 NS 产生颅神经嵴细胞 (CNCC),可以进一步培养。通过控制起始细胞的数量,这种方法减少了 NS 之间大小和形状的可变性,并提高了实验之间的可重复性。最后,该培养系统适用于多种应用,并提供更高的灵活性,使其高度可定制,适用于多重实验条件。
引言
颅神经嵴细胞 (CNCC) 是一种干细胞样细胞群,起源于发育中的胚胎的最前部,位于神经板和表面外胚层1 之间的边界。然后 CNCC 经历上皮到间充质转化 (EMT),从神经上皮分层,并向背腹方向迁移到胚胎中的不同位置,在那里它们分化成多种细胞类型2。研究这种细胞群非常有趣,因为它具有非凡的可塑性3 和分化为外胚层和间充质衍生物(如颅面骨和软骨)的独特能力4。尽管 CNCC 在胚胎中相对容易获得,但它们是一个细胞数量较少的瞬时群体,因此难以在体内进行系统机制研究。在过去几年中,已经分离并表征了 CNCC 细胞系以克服这些限制。特别是,O9-1 CNCC 细胞系是研究迁移和迁移后神经嵴发育的绝佳工具 5,6;然而,该细胞系不允许研究导致神经嵴诱导和规范的迁移之前的早期事件。在这方面,体外分化方案的开发取得了重大进展,通过使用类似于胚胎干细胞 (ESC) 集落分化后获得的称为神经球 (NS)7,8- 的发育中的神经上皮细胞的 3D 结构来区分培养皿中的 CNCC。这些 3D 方案稳健地产生大量 CNCC,允许进行生化和基因组机制研究 9,10。将 NS 在补充 N2B27 的培养基中的低附着板上培养,并与成纤维细胞生长因子 (FGF) 和表皮生长因子 (EGF)一起10,11 以刺激细胞增殖。这些方案在培养皿中进行,在同一板中培养大量 NS。在生长的 NS 中,细胞聚集并继续分裂 - 成熟后达到 100-200 μm 的直径。在成熟时(大约第 5 天),NS 附着在底物上并分化成类似于体内对应物的 CNCC 9,12。然后这些 CNCC 经过 EMT 并分层到板表面。根据 NS 的大小,可以观察到形态差异,因为由于营养物质和氧气的可用性较低,较大的球体在核心中会显得更暗,从而导致细胞凋亡13。虽然这种类型的程序在分化终点产生大量 CNCC,但它存在一些局限性,使得研究分化过程中发生的各种分子动力学几乎是不可能的。首先,使用 ESC 集落 - 大小不同 - 使得难以控制每个实验的起始细胞数。这导致产生各种形状和直径的 NS,这些 NS 通过激活特定的信号通路以不同的方式发育,导致细胞分化改变,因此在给定的时间点无法形成均匀的样品。其次,在同一板中培养多个 NS 通常会导致它们融合在一起14 并可能释放影响其邻居微环境的信号分子,从而影响其发育。总而言之,这些程序在样品和实验之间会产生很大的可变性。
在这里,我们提出了一种策略来克服这些困难,通过在未 TC 处理的 U 形底 96 孔板中聚集小鼠 ESC (mESC) 来产生能够产生 CNCC 的单个 NS。与从已经建立的神经嵴细胞系开始相比,从 mESC 开始可以研究 CNCC 开发的规格过程和早期阶段。该方案首先解聚 mESC 菌落以获得单细胞悬液,然后在未 TC 处理的 U 底 96 孔板的每个孔中接种特定数量的 mESC。将细胞聚集两天,然后移至未经 TC 处理的平底 96 孔板中,其中 NS 将能够附着在板底部。通过在分化过程中控制起始细胞数和每个 NS 的微环境,该方案减少了样品的可变性,从而提高了实验的可重复性。我们相信这将是设计多重实验的便捷平台,例如测试不同培养条件的效果或进行基因扰动筛选。
研究方案
1. 从小鼠 ESC 集落生成单细胞悬液
注意:该方案适用于在明胶包被的 TC 处理的 6 孔板中的灭活饲养员上生长的 CK35 mESC(一种能够进行生殖系传播的 mESC 系,然后可以选择开发 体内模型 15)。TC 处理的 6 孔板的一个孔应产生大约 1.5 × 10个 6 mESC,这对于方案的其余部分来说已经足够了。如有必要,可以按比例扩展。根据所选的 ESC 菌株和维持培养方法以及适当的培养基调整初始步骤。该方案应在无菌条件下进行。有关本协议中使用的所有材料、试剂和设备的详细信息,请参阅 材料表 。
- 从 mESC 开始,在 mESC 培养基中生长的 70%-80% 汇合度。有关本研究中使用的 mESC 培养基成分,请参见 表 1 。
注意:不要让 mESC 生长超过 80% 汇合,因为它们会开始分化,这会影响聚集过程。集落必须紧凑并显示出健康的形态(没有裂缝或波浪,明显的核质对比)。 - 制备 CNCC 分化培养基。CNCC 分化培养基组成见 表 1 。
注:添加生长因子后,培养基可在 4 °C 下储存长达 3 周。 确保培养基避光。 - 在 DMEM-Knockout 培养基中制备浓度为 2 mg/mL 的新鲜胶原酶溶液。
注:使用胶原酶可确保仅分离菌落而不是饲养层,因为它们在以下步骤中的存在会干扰 NS 聚集。使用前用 0.22 μm 过滤器过滤胶原酶溶液。 - 从 mESC 中吸出 ESC 培养基。
- 在孔的一侧轻轻加入 1 mL 的 PBS。轻轻摇晃板以确保均匀洗涤。
- 去除 PBS 并替换为 2 mL 胶原酶溶液。在 37 °C 下孵育 30-45 分钟。
- 前 20 分钟后,在光学显微镜下以 10 倍放大倍率检查板,然后每 5 分钟检查一次。
- 当菌落显示出卷起的边缘时,用力敲击板侧,菌落就会分离。
- 使用 5 mL 血清移液管收集菌落并将其转移到 15 mL 锥形管中。
注意:在光学显微镜下检查板是否有残留菌落。这些可以用 PBS 洗涤液收集。 - 在室温 (RT) 下以 16 × g 离心菌落 3 分钟。
- 从锥形管中吸出尽可能多的培养基,注意不要干扰管底部的菌落。
- 加入 1 mL 0.05% 胰蛋白酶溶液,并将试管在 37 °C 下孵育 5 分钟。
- 通过上下剧烈移液,先用 p1000,然后用 p200 微量移液器,解离管中的菌落。
注:这可确保获得单细胞悬液。 - 加入 2 mL mESC 培养基以封闭胰蛋白酶,并在室温下以 160 × g 离心 3 分钟。去除上清液并加入 1 mL CNCC 分化培养基。
- 按照制造商的说明,使用自动细胞计数设备或显微镜下的标准化系统对细胞进行计数。
- 计数后,用足够的 CNCC 分化培养基稀释,以获得每 50 μL 3000 个活细胞的浓度。
- 使用 p200 微量移液器,在未经 TC 处理的 U 形底 96 孔板的每个孔中接种 50 μL 细胞悬液,然后用 CNCC 分化培养基加满孔直至 200 μL。
注:填充板时,不时用 p1000 微量移液管重悬单细胞悬液,以获得均匀的浓度。 - 在 37 °C、5% CO2 的培养箱中孵育过夜。
2. 转移到平底 96 孔板中进行 CNCC 鉴别
- 第二天(第 1 天),在光学显微镜下观察板。确保在每个孔的底部可以看到一个边界清晰的小细胞簇。将板放回培养箱中过夜。
注意:主聚集体周围可能有一些细胞,一些是死细胞。这不会干扰 NS 聚合。 - 第 2 天,从每个孔中缓慢去除 100 μL 培养基。
- 吸取培养基时,注意不要去除 NS。为避免这样做,请将移液器吸头靠近表面并远离底部。
- 将 p200 微量移液器的尖端从尖端切下约 3-4 毫米。使用此方法吸出带有剩余培养基的 NS。
注意:为便于吸取 NS,请在吸液前轻轻上下移液几次。 - 将 NS 和剩余的培养基转移到未经 TC 处理的平底 96 孔板中,并在光学显微镜下验证转移,然后在每个新孔上放置 100 μL 预热的 CNCC 分化培养基。将 NS 留在 37 °C、5% CO 2 的培养箱中, 直至第 4 天。
- 第 4 天,从每个孔中取出 100 μL 培养基,并用 100 μL 预热的 CNCC 分化培养基代替。
注:为避免干扰板底部的 NS 附着,请缓慢吸液并更换培养基。 - 在第 5 天和第 6 天,在光学显微镜下检查 NS 附件。确保较轻的细胞 - 从 NS 分层 - 开始围绕 NS 的主体。
- 第 7 天,按照 2.5 中的说明更换培养基。每 2 天使用相同的程序更换培养基,直到研究结束。
3. 国家网信证书传代及维护
注意:一旦 NS 周围有足够数量的可见细胞,就可以进行 CNCC 传代。这可能最早在第 7 天,因为较早的时间点无法提供足够数量的 CNCC。
- 准备 CNCC 维护培养基。CNCC 维护培养基成分见 表 1 。
- 在将其添加到培养基中之前,通过 0.22 μm 过滤器溶解后过滤 BSA。添加生长因子后,将培养基在 4 °C 下储存长达 3 周。 确保培养基避光。
- 在 PBS 中制备 7.5 μg/mL 的纤连蛋白。用力混合。
- 通过每孔添加 100 μL 纤连蛋白溶液,包被未经 TC 处理的 96 孔板的孔。在 RT 下让涂层在引擎盖下 30 分钟。
注:如果 CNCC 用于免疫荧光染色,请在涂布前将无菌玻璃盖玻片放在孔底部。确保载玻片保持在孔的底部并且不会漂浮,以避免涂覆与要使用的载玻片相反的一侧。按照第 5 节中的说明进行 CNCC 固定和安装。 - 同时,在未 TC 处理的平底 96 孔板中,从孔中吸出尽可能多的 CNCC 分化培养基,并用 50 μL accutase 代替。在 37 °C 孵育 5 分钟。
- 孵育后,每孔加入 100 μL CNCC 维持培养基以淬灭 accutase。从接收未 TC 处理的平底 96 孔板的孔中去除纤连蛋白。通过将分离的迁移后 CNCC 穿过接收非 TC 处理的平底 96 孔板孔顶部的 40 μm 过滤器来过滤它们。
注意:这将过滤掉之前未删除的细胞团块或剩余 NS。在相同条件下生长的 CNCC 可以合并在一个 50 mL 管中,然后接种在 TC 处理的 6 孔板的同一孔中。在这种情况下,用 1 mL 纤连蛋白包被孔,并使用 1 mL CNCC 维持培养基淬灭 accutase。 - 让迁移后 CNCC 在 37 °C 下附着 15-30 分钟。 丢弃培养基并替换为 100 μL CNCC 维护培养基。每 2 天更换一次培养基。
注意:轻轻添加培养基,因为快速流动会诱导 CNCC 分化为神经衍生物。如果在 6 孔格式中工作,请使用 1 mL 的 CNCC 维护培养基。
4. 用于免疫荧光的 NS 固定和封片
- 在所需的时间点,通过切割 p200 微量移液器的尖端,将 NS 从未经 TC 处理的平底 96 孔板转移到 DNA 低结合 2 mL 管中,然后轻轻上下移液以拾取 NS。
注意:在以后的时间点(从第 7 天开始),NS 将大到足以被肉眼看到,但也更难分离。 - 让 NS 在 RT 下在试管中沉淀 3 分钟,去除尽可能多的培养基,然后用 1 mL 冷 PBS 冲洗。
注意:如果从早期时间点(第 3-4 天之前)转移小 NS,请在 16 × g 下旋转 3 分钟,以确保 NS 沉降到底部。 - 去除 PBS,并在化学通风橱中更换为 2 mL 4% PFA 的 PBS 溶液。在 RT 下孵育 20 分钟。
- 加入 4% PFA 溶液后,缓慢倒置试管,并在固定期间将其放在侧面。目标是稍微分散 NS,以便它们在此步骤中不会粘在一起。
- 去除 4% PFA 溶液(在化学罩中)并用 1 mL 冷 PBS/0.5% Tween20 洗涤 NS。让它在 RT 下沉淀 3 分钟。总共重复此作 3 次。
注意:NS 将沉淀在底部。 - 去除 PBS/0.5% Tween20 并加入 2 mL PBS/0.1% Triton X-100。将管子倒置,让它放在一边。在 RT 下孵育 1 小时。
- 如步骤 4.4 所示,在冷 PBS/0.5% Tween20 中洗涤 NS 3 次。
- 去除 PBS/0.5% Tween20 并在 4 °C 下用 2% BSA 的 PBS 溶液封闭至少 1 小时,最好过夜。
注:样品可在 2% BSA/PBS 中在 4 °C 下储存长达 1 周。 避光。 - 通过将正确稀释的一抗添加到 2% BSA/PBS 中,最终体积为 500 μL 来制备一抗溶液。有关本研究中使用的一抗混合物,请参见 表 2。
- 尽可能多地去除封闭溶液,并通过切割 p200 微量移液器的尖端将 NS 转移到 0.5 mL 试管中。
- 加入一抗溶液并缓慢上下移液以重悬 NS。在 4 °C 的旋转器上孵育过夜。
- 在 RT 下用冷 PBS 洗涤 NS 3 次,持续 5 分钟。
- 通过在 2% BSA/PBS 中稀释所选二抗并加入 1/1000 DAPI 来制备二抗溶液。有关本研究中使用的二抗混合物,请参见 表 2。
注意:请避光管子。 - 用 500 μL 二抗溶液替换 PBS,并用铝箔包裹试管以避光。在 RT 下在旋转器上孵育 1 小时。
- 如步骤 4.11 所示,在冷 PBS 中洗涤 NS 3 次。
- 在不吸出 NS 的情况下去除尽可能多的 PBS,用 50 μL 的清除剂代替,并按照制造商的说明进行作。
- 在 RT 中避光孵育过夜。
- 准备安装室。
- 在显微镜载玻片上,放置三层双面胶带。使用透明的无纤维胶带以避免安装室中有残留物。
- 使用剃须刀在双带上切出 3 mm × 8 mm 的窗口。
注意:腔室尺寸取决于采样时间点。本例适用于托管 50 μL 封固剂,最适合在以后的时间点(第 7-9 天)使用 10-20 个单 NS。
- 在立体镜下,通过切割低粘附力 p200 微量移液器吸头,小心地将清除剂中的 NS 转移到安装室中。使用 2 倍到 4 倍之间的放大倍率来提供整个腔室的视野和足够的放大倍率来识别 NS。如果立体镜配备了荧光成像,则使用蓝色荧光滤光片将更容易识别 NS,因为 DAPI 染色将使原本透明的 NS 脱颖而出。
注意:确认培养基在腔室上方形成轻微凸起的弯月面。这将确保腔室中没有气泡。 - 将盖玻片放在表面上,轻轻按压其侧面以使其粘附。在立体镜下执行此步骤,并验证 NS 是否未被推出腔室。
- 在 4 °C 避光储存直至成像。
5. 用于免疫荧光的 CNCC 固定和封片
- 从孔中取出 CNCC 维护培养基并用 PBS 洗涤。通过在孔的侧面移液轻轻添加 PBS。
- 按照步骤 4.3-4.14 中的说明进行固定、透化和染色。
- 通过在载玻片上添加安装介质,使用镊子抓住并旋转盖玻片,使迁移后的 CNCC 面向载玻片,然后将其放在液滴上,将盖玻片安装在显微镜载玻片上。
- 可选:用指甲油或其他常用的密封系统密封盖玻片。
- 在 4 °C 避光储存直至成像。
结果
按照方案,解离 mESC 集落,并将 3000 个细胞接种在未经 TC 处理的 U 型底 96 孔板中。第 2 天,将聚集的 NS 转移到未经 TC 处理的平底 96 孔板中,以允许它们附着。 图 1A 提供了 NS 聚合协议的简化可视化。NS 培养至第 9 天,然后进行免疫荧光染色处理。将从 NS 迁移到板上的细胞转移到盖玻片上进行成像,并在 CNCC 维持培养基中培养至第 13 天。同时,在培养皿中生成 NS 的方案作为参考和比较点进行。该实验的总体目标是减少在培养皿中执行的方案中观察到的 NS 到 NS 变异性。
当在未经 TC 处理的 96 孔板中单独培养时,NS 显示出降低的表型变异性。所有 NS 在第 5 天开始附着,而附着的 NS 的比例非常可变,总体而言,在培养皿中培养时,第 7 天不太重要(图 1B,C)。此外,当在培养皿中培养时,始终观察到 NS 融合,如第 4 天所观察到的那样(图 1B)。在第 9 天,在未 TC 处理的 96 孔板和培养皿培养条件下都可以观察到 NS 的广泛细胞分层(图 1B、C)。在第 4 天和第 7 天收集 NS 以比较方案之间的大小变异性。在非 TC 处理的 96 孔板中培养的 NS 在第 4 天和第 7 天都显示出大小变异性显着降低。相比之下,当在培养皿中培养时,NS 显示出重要的大小变异性(图 2A)。在未经 TC 处理的 96 孔板中,第 4 天的 NS 直径范围在 139 μm 和 295 μm 之间,第 7 天的 NS 直径在 383 μm 和 552 μm 之间,而在培养皿中,第 4 天的 NS 直径范围在 126 μm 和 505 μm 之间,第 7 天的 NS 直径范围在 106 μm 到 868 μm 之间。从第 2 天到第 9 天,每天收集在非 TC 处理的 96 孔板中培养的 NS,并测量它们的生长情况。细胞数量呈指数级增长,从第 2 天的平均 1082 个细胞和第 9 天的平均 48352 个细胞(图 2B),而 NS 直径大小遵循线性增长,第 2 天的平均直径为 136 μm,第 9 天的平均直径为 570 μm(图 2C)。
在未经 TC 处理的 96 孔板中培养后,对 NS 和分层细胞进行 CNCC 标志物 AP2α、PAX7 和 SOX916 以及 EMT 标志物 TWIST116 染色。样品采集、染色和安装方案的示意图如图 3 所示。用于 NS 免疫荧光分析的安装室的代表性图像如图 4A 所示。该分析旨在验证在未经 TC 处理的 96 孔板中培养的 NS 产生经过 EMT 的 CNCC,并且分层细胞呈现 CNCC 身份。NS 和迁移后 CNCC 在第 9 天和第 13 天都显示出 AP2α、SOX9 和 TWIST1 的广泛表达,而 PAX7 - 一种迁移前 CNCC 标志物16 - 仅存在于 NS 中,而不存在于迁移后 CNCC 中(图 4C)。总之,这些结果证实了未经 TC 处理的 96 孔板 NS 培养方案生成的 CNCC,该 CNCC 经过 EMT 并在板表面迁移。迁移后第 9 天 NS 和第 13 天 CNCC 也对神经元标志物 TUJ117 进行染色(图 4B),以可视化发育中的 NS 中的神经元衍生物。
最后,对 mESC 和迁移后 CNCC 第 13 天进行 RT-qPCR 基因表达分析(图 4D)。使用 Trizol 提取 RNA,然后按照制造商的说明进行 RT-qPCR。在迁移后 CNCC 中,神经嵴标志物 Ap2α 、 Sox9 和 Sox1018 的表达与 mESC 相比分别增加了 5.42 倍、51.07 倍和 46.75 倍。与 mESC 相比,神经祖细胞标志物 Eya2 、 Ascl1 和 Neurog219 在迁移后 CNCC 第 13 天的表达也分别增加了 7.78 倍、43.92 倍和 13.83 倍。间充质/成骨细胞标志物 Mef2c 、 Alx4 和 Ets120在迁移后 CNCC 中的表达分别比 mESC 增加了 168.44 倍、156.47 倍和 41.23 倍( 表 3 中的引物序列)。总之,这表明该方案中产生的迁移后 CNCC 不偏向于神经元或外胚质命运。

图 1:NS 聚集工作流程和与培养皿培养的 NS 的表型比较。 (A) mESC 接种和 NS 培养的工作流程。(B) 在培养皿中进行的 NS 分化的代表性图像。从早期时间点可以观察到不同大小的 NS。箭头表示 NS 融合。白色箭头显示细胞从 NS 分层。(C) 在非 TC 处理的 96 孔板中进行的时间过程 NS 分化过程中的代表性图像。黑色箭头显示细胞从 NS 分层。日期显示在顶部。比例尺代表 100 μm。 请单击此处查看此图的较大版本。

图 2:汇总的 NS 生长特征以及与培养皿培养的 NS 的比较。 (A) 小提琴图显示培养皿和非 TC 处理的 96 孔板培养方案中的 NS 大小变化。每个方案和时间点收集 20 个 NS。执行标准差变异性的 F 检验,结果显示在图表上方的条形中。(B) 在未 TC 处理的 96 孔板中分化过程中 NS 细胞数量的时程定量。(C) 定量分析未 TC 处理的 96 孔板分化过程中 NS 直径尺寸变化。使用 CellProfiler 4.2.5 进行细胞计数。使用 Graphpad Prism 9 进行图形生成和回归分析。对于每个时间点,量化 5 至 10 NS。 请单击此处查看此图的较大版本。

图 3:NS 采集和免疫荧光分析工作流程。 代表 NS 收集、免疫荧光染色准备和成像的示意图,顶部指示了每个步骤的指示性时间跨度。 请单击此处查看此图的较大版本。
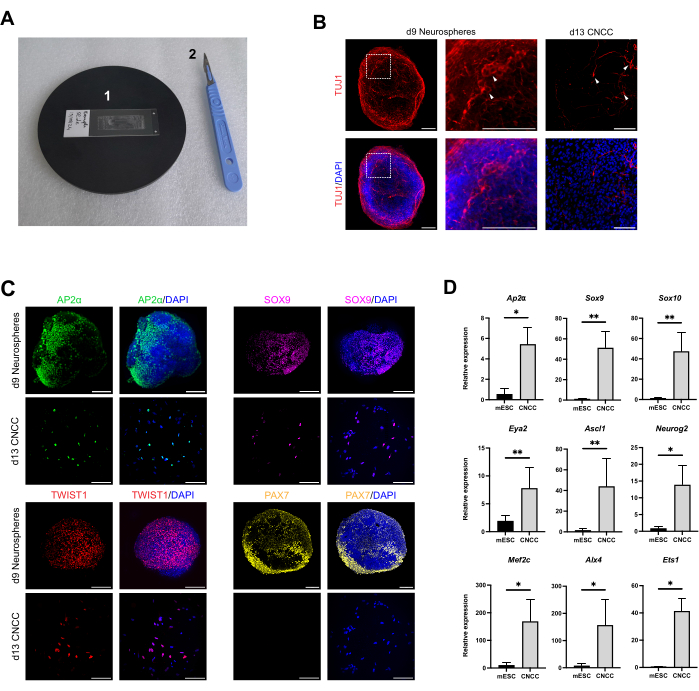
图 4:在未经 TC 处理的 96 孔板中生长的 NS 生成 CNCC。 (A) 成像载玻片 (1) 和用于切割腔室的手术刀 (2) 的代表性图片。(B) 第 9 天 NS 的免疫荧光图像(左)和迁移后 CNCC 第 13 天 (右),显示神经元标志物 TUJ1 的表达。白色箭头表示细胞体。虚线方块表示中间面板中显示的缩放区域。比例尺代表 100 μm。(C) 第 9 天(顶部)和迁移后 CNCC 第 13 天(底部)的免疫荧光图像,显示 CNCC 规范标志物 AP2α、CNCC 标志物 PAX7 和 SOX9 以及 EMT 标志物 TWIST1 的表达。比例尺表示 100 μm。(D) 比较 mESC(黑色)和迁移后 CNCC(灰色)中相对基因表达的柱状柱状图。将 CNCC (Ap2α、 Sox9 和 Sox10 )、神经元 (Eya2、 Ascl1、Neurog2) 和外胚质 (Mef2c、Alx4、Ets1)、标记基因的表达与管家基因 ActinB、Ywhaz 和 Tbp 的平均表达进行比较。误差线表示根据三个技术重复计算的标准误差(星号 = p<0.05,双星号 = p<0.01)。使用 GraphPad Prism 9 生成图形。 请单击此处查看此图的较大版本。
表 1:培养基成分。请点击此处下载此表格。
表 2:研究中使用的一抗和二抗。请点击此处下载此表格。
表 3:引物序列。请点击此处下载此表格。
讨论
体外 3D 分化模型允许分析在 2D 细胞培养中可能难以或无法观察到的复杂细胞相互作用。已经开发了几种模型来研究体外 CNCC 的发展。这些通常直接来源于 ESC 集落 7,21 或组织外植体22,23。尽管这些系统已被证明可以有效地产生神经嵴细胞,但此类方法对培养方法和微环境表现出显着的敏感性,这导致 NS24 内部的细胞组成和细胞特性存在差异。此外,这些方法没有考虑 ESC 集落大小和细胞数的初始异质性。
为了解决这些限制,本文概述了一种在未经 TC 处理的 96 孔板中通过 mESC 聚集生成单个 NS 的方法。该方案允许通过从 mESC 菌落生成单细胞悬液并控制实验中的初始细胞数量来标准化起始条件。这导致分化过程中 NS 直径、大小、变异性和细胞数量的减少。此外,每孔产生单个 NS 消除了 NS 融合,并通过释放无法控制的细胞外因子来防止邻近的 NS 影响微环境。使用 96 孔板规格具有额外的优势,例如 (i) 评估起始培养条件的影响,例如细胞状态或细胞数量;(ii) 在标准化环境中测试大量培养条件;(iii) 进行实时成像实验;(iv) 使用 siRNA 介导的基因沉默设计高通量遗传扰动筛选。值得注意的是,该方案可以使用小鼠和人类 ESC 系 9,25 进行。总之,这些将使人们能够进一步研究控制 CNCC 可塑性和细胞命运决定的分子机制。
该方案的一个限制是产生的 NS 数量减少,这导致以下培养物的 CNCC 减少。虽然 CNCC 稍后可以扩增10,但这限制了该方案在需要大量细胞的程序中的使用。第二个潜在的缺点是 NS作需要更多的灵巧性,这可能导致样本丢失 - 尤其是在早期的时间点 - 从而进一步减小样本量。这可以通过增加使用的板数量来克服。
该方案的一个关键方面是从 mESC 生成单细胞悬液。在聚集之前去除任何用于培养 mESC 的饲养层细胞至关重要,因为它们会干扰聚集并导致意外的表型和误导性结果。
总之,该方法提供了一种可重复、可扩展且高度可调制的方法来生产 NS 以与 体内 研究并行使用。
披露声明
作者声明没有利益冲突。
致谢
我们感谢 Remi Xavier Coux 博士关于引物设计和细胞培养专业知识的建议。这项工作得到了欧洲研究委员会 (ERC Starting Grant 101039995 - REGENECREST) 和 Fondation pour la Recherche Médicale (Amorçage - AJE202205015403) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 μm syringe filters | ClearLine | 146560 | |
| 15 mL High-Clarity Polypropylene Conical Tube | Falcon | 352096 | |
| 200 µL ClearLine Plus Low Binding Filter Tips | Dutscher | 713263 | |
| 40 µm filters | Falcon | 352340 | |
| 5 mL Serological pipette | Starstedt | 86.1253.001 | |
| 50 mL High-Clarity Polypropylene Conical Tube | Falcon | 352070 | |
| Accutase | Merck-Sigma | A6964 | |
| Alexa Fluor 488 donkey anti rabbit IgG (H+L) | Thermofisher Scientific | A21206 | |
| Alexa Fluor 594 donkey anti mouse IgG (H+L) | Thermofisher Scientific | A21203 | |
| Alexa Fluor 647 donkey anti goat IgG (H+L) | Thermofisher Scientific | A31571 | |
| Antibiotic-antimycotic solution | Merck-Sigma | A5955 | |
| B27 PLUS supplement | Thermofisher Scientific | 17504044 | |
| Bovine serum albumin (BSA) | Merck-Sigma | A9418 | |
| Chloroform | Carlo Erba | 438601 | |
| Collagenase Type IV | Thermofisher Scientific, Gibco | 17104019 | |
| Costar 6 well clear TC-treated multiple well plates | Corning | 3516 | |
| Cover glasses, round | VWR | 630-2113 | |
| DMEM KnockOut | Thermofisher Scientific | 10829018 | |
| DMEM/F12+Glutamax | Thermofisher Scientific | 10565018 | |
| DMEM high glucose | Merck-Sigma | D0822 | |
| DNA LoBind Tubes, 2 mL | Eppendorf | 30108078 | |
| DNase/RNase-Free Distilled Water | Thermofisher Scientific | 10977-035 | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Thermofisher Scientific | 14190144 | |
| Eppendorf Safe-Lock Tubes, 0.5 mL | Eppendorf | 30121023 | |
| Eppendorf Safe-Lock Tubes, 2 mL | Eppendorf | 30120094 | |
| ESGRO mLIF Medium Supplement | Merck-Sigma | ESG1107 | |
| Ethanol 70% | Carlo Erba | 528170 | |
| Fetal Bovine Serum | Merck-Sigma | F7524 | |
| Fibronectin | Merck-Sigma | F085-2MG | |
| Fluoromount-G | Invitrogen | 00-4958-02 | |
| Gelatin solution | Merck-Sigma | ES-006-B | |
| GlutaMAX | Thermofisher Scientific | 35050061 | |
| Human EGF | Peprotech | AF-100-15-500UG | |
| Human FGF-basic | Peprotech | 100-18B | |
| Human SOX9 Antibody | R&Dsystems | AF3075 | |
| Insulin from bovine pancreas | Merck-Sigma | I6634 | |
| iScript cDNA Synthesis Kit | Biorad | 1708891 | |
| Mouse Anti-Human AP-2 alpha Monoclonal Antibody, Unconjugated | DSHB | 3B5 | |
| Mouse Anti-Human PAX7 Monoclonal Antibody, Unconjugated | DSHB | PAX7 | |
| N2 supplement | Thermofisher Scientific | 17502048 | |
| Neurobasal Medium | Thermofisher Scientific | 21103049 | |
| Non-Tissue culture treated plate, 96 well, Flat bottom | Falcon | 351172 | |
| Non-Tissue culture treated plate, 96 well, U-bottom | Falcon | 351177 | |
| Paraformaldehyde 16% solution, em grade | Electron Microscopy Sciences | 15710 | |
| Propan-2-ol | Carlo Erba | 415154 | |
| Purified anti-Tubulin β 3 (TUJ1) Antibody | Biolegend | MMS-435P | |
| RapiClear 1.47 | Sunjin Lab | RC147001 | |
| RapiClear 1.52 | Sunjin Lab | RC152001 | |
| Scotch Double Sided 12.7 mm × 22.8 m | Clear fibreless double sided tape | ||
| SensiFAST SYBR No-ROX Kit | Meridian Bioscience | BIO-98020 | |
| Sterile Disposable Surgical Scalpels | Swann-Morton | 05XX | |
| Superfrost Plus Adhesion Microscope Slides | Epredia | J1800AMNZ | |
| Triton X-100 | Thermofisher Scientific | A16046.AP | |
| TRIzol Reagent | FisherScientific | 15596026 | |
| Trypsine-EDTA (0.05%) | Thermofisher Scientific | 25300054 | |
| Tween-20 | Fisher Scientific | 10113103 | |
| TWIST1 Rabbit mAb (IF Formulated) | Cell signaling technology | E7E2G | |
| β-mercaptoethanol | Thermofisher Scientific | 31350010 |
参考文献
- Rothstein, M., Bhattacharya, D., Simoes-Costa, M. The molecular basis of neural crest axial identity. Dev Biol. 444, S170-S180 (2018).
- Smeriglio, P., Zalc, A. Cranial neural crest cells contribution to craniofacial bone development and regeneration. Curr Osteoporos Rep. 21 (5), 624-630 (2023).
- Zalc, A., et al. Reactivation of the pluripotency program precedes formation of the cranial neural crest. Science. 371 (6529), eabb4776 (2021).
- Perera, S. N., Kerosuo, L. On the road again: Establishment and maintenance of stemness in the neural crest from embryo to adulthood. Stem Cells. 39 (1), 7-25 (2021).
- Nguyen, B. H., Ishii, M., Maxson, R. E., Wang, J. Culturing and manipulation of O9-1 neural crest cells. J Vis Exp. (140), e58346 (2018).
- Ishii, M., Arias, A. C., Liu, L., Chen, Y. B., Bronner, M. E., Maxson, R. E. A stable cranial neural crest cell line from mouse. Stem Cells Dev. 21 (17), 3069-3080 (2012).
- Rada-Iglesias, A., Bajpai, R., Prescott, S., Brugmann, S. A., Swigut, T., Wysocka, J. Epigenomic annotation of enhancers predicts transcriptional regulators of human neural crest. Cell Stem Cell. 11 (5), 633-648 (2012).
- Cederquist, G. Y., et al. Specification of positional identity in forebrain organoids. Nat Biotechnol. 37 (4), 436-444 (2011).
- Rada-Iglesias, A., Bajpai, R., Swigut, T., Brugmann, S. A., Flynn, R. A., Wysocka, J. A unique chromatin signature uncovers early developmental enhancers in humans. Nature. 470 (7333), 279-283 (2011).
- Prescott, S. L., et al. Enhancer divergence and cis-regulatory evolution in the human and chimp neural crest. Cell. 163 (1), 68-83 (2015).
- Chaddah, R., Arntfield, M., Runciman, S., Clarke, L., van der Kooy, D. Clonal neural stem cells from human embryonic stem cell colonies. J Neurosci. 32 (23), 7771-7781 (2012).
- Bajpai, R., et al. CHD7 cooperates with PBAF to control multipotent neural crest formation. Nature. 463 (7283), 958-962 (2010).
- Sipahi, R., Zupanc, G. K. Stochastic cellular automata model of neurosphere growth: Roles of proliferative potential, contact inhibition, cell death, and phagocytosis. J Theor Biol. 445, 151-165 (2018).
- Mori, H., et al. Effect of neurosphere size on the growth rate of human neural stem/progenitor cells. J Neurosci Res. 84 (8), 1682-1691 (2006).
- Kress, C., Vandormael-Pournin, S., Baldacci, P., Cohen-Tannoudji, M., Babinet, C. Nonpermissiveness for mouse embryonic stem (ES) cell derivation circumvented by a single backcross to 129/Sv strain: establishment of ES cell lines bearing the Omd conditional lethal mutation. Mamm Genome. 9 (12), 998-1001 (1998).
- Simões-Costa, M., Bronner, M. E. Establishing neural crest identity: a gene regulatory recipe. Development. 142 (2), 242-257 (2015).
- Memberg, S. P., Hall, A. K. Dividing neuron precursors express neuron-specific tubulin. J Neurobiol. 27 (1), 26-43 (1995).
- Kim, C. N., Shin, D., Wang, A., Nowakowski, T. J. Spatiotemporal molecular dynamics of the developing human thalamus. Science. 382, eadf9941 (2023).
- Grimaldi, A., Comai, G., Mella, S., Tajbakhsh, S. Identification of bipotent progenitors that give rise to myogenic and connective tissues in mouse. ELife. 11, e70235 (2022).
- To, K., et al. A multiomic atlas of human early skeletal development. Nature. 635 (8039), 657-667 (2024).
- Bajpai, R., et al. Molecular stages of rapid and uniform neuralization of human embryonic stem cells. Cell Death Differ. 16 (6), 807-825 (2009).
- Kerosuo, L., Nie, S., Bajpai, R., Bronner, M. E. Crestospheres, Long-term maintenance of multipotent, premigratory neural crest stem cells. Stem Cell Reports. 5 (4), 499-507 (2015).
- Abe, S., Yamaguchi, S., Sato, Y., Harada, K. Sphere-derived multipotent progenitor cells obtained from human oral mucosa are enriched in neural crest cells. Stem Cells Transl Med. 5 (1), 117-128 (2016).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol Neurobiol. 34 (3), 153-161 (2006).
- Ziegler, L., Grigoryan, S., Yang, I. H., Thakor, N. V., Goldstein, R. S. Efficient generation of Schwann cells from human embryonic stem cell-derived neurospheres. Stem Cell Rev Rep. 7 (2), 394-403 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。