Method Article
تأثير ديكوتيون مضاد للتعب على السلوكيات والمؤشرات المصلية في نموذج فئران التعب المركزي
In This Article
Summary
هنا ، نقدم بروتوكولا لتقييم آثار مغلي مكافحة التعب (AFD) على التعب المركزي في الفئران على غرار طريقة المنصات المتعددة المعدلة (MMPM) من خلال مراقبة كل من استجاباتهم السلوكية والعلامات المصلية.
Abstract
هدفت هذه الدراسة إلى تقييم آثار مغلي مكافحة التعب (AFD) ضد التعب المركزي من خلال ملاحظة السلوكيات والمؤشرات المصلية للفئران على غرار طريقة المنصات المتعددة المعدلة (MMPM) بعد التدخل الدوائي. تم استخدام قياسات قوة القبضة لتقييم قوة عضلات الفئران. تم استخدام اختبار المجال المفتوح لتقييم السلوك الشبيه بالقلق ، بينما تم إجراء اختبار متاهة المياه موريس لتقييم وظيفة الذاكرة للفئران. بعد التقييمات السلوكية ، تم جمع عينات مصل الفئران لقياس تركيزات الكورتيكوستيرون (CORT) وحمض اللاكتيك (LAC). تم تحديد تركيز LAC باستخدام طريقة قياس الألوان ، بينما تم قياس تركيز CORT باستخدام طريقة مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA). بالمقارنة مع مجموعة التحكم الفارغة ، بعد نمذجة MMPM ، أظهرت الفئران انخفاضا كبيرا في قوة القبضة وضعف القدرة على الذاكرة. كشف تحليل المصل عن زيادة مستويات LAC و CORT في فئران المجموعة النموذجية. يمكن ل AFD عكس هذه التغييرات السلبية بشكل ملحوظ إلى حد ما. تسلط هذه النتائج الضوء على الآثار الإيجابية ل AFD والإنزيم المساعدQ10 على القدرات البدنية والمعرفية والتغيرات في مستويات المؤشرات الحيوية في المصل لفئران التعب المركزي.
Introduction
التعب هو ظاهرة متعددة الأوجه وغير محددة تتميز عادة بالشعور بالتعب وانخفاض القدرة على العمل1. يمكن تصنيفه على أنه إما التعب المحيطي ، والذي يحدث على المستوى العضلي ، أو التعب المركزي ، الذي ينشأ في الجهاز العصبي المركزي3،4. يمكن أن يكون التعب المركزي المطول مساهما كبيرا في المشكلات النفسية ، بما في ذلك القلق والاكتئاب والضيق النفسي ومشاكل الذاكرة5،6. على الرغم من التسبب في ضائقة كبيرة ، إلا أن هناك ندرة في أدوية معينة تستهدف التعبالمركزي 7. في حين أن ميثيل فينيديت ، وهو منشط للجهاز العصبي المركزي ، يمكن أن يوفر راحة مؤقتة ، إلا أن آثاره الجانبية ، مثل الأرق والخفقان قد تؤدي إلى تفاقم الحالة8،9.
في التطبيقات السريرية السابقة ، أظهر الطب الصيني التقليدي نتائج واعدة في علاج التعب المركزي ، بما في ذلك مناهج مثل مغلي الفم والوخز بالإبر وتاي تشي10،11،12. مغلي مضاد للتعب (AFD) هو تركيبة فعالة طورها البروفيسور لي فنغ بناء على خبرة سريرية واسعة وأظهرت آثارا علاجية إيجابية. يتكون من Astragalus membranaceus (Huangqi) و Fructus aurantii (Zhiqiao) و Fructus crataegi (Shanzha) و Schisandra chinensis (Wuweizi) و Angelica sinensis (Danggui) و Dendrobium officinale (Shihu) ، بنسبة 15: 15: 10: 5: 7: 8. تم تركيز مغلي AFD إلى 110 مل بعد الغليان بعشرة أضعاف حجم الماء منزوع الأيونات لمدة 1 ساعة ثلاث مرات. في دراسة سابقة ، أنشأنا نموذجا حيوانيا للإرهاق المركزي باستخدام طريقة المنصات المتعددة المعدلة (MMPM) وأكدنا مظهر من مظاهر التعب المركزي من خلال تقييمات الناقل العصبي السلوكي والجهاز العصبيالمركزي 13. في هذه الدراسة ، استخدمنا تدخل AFD في النموذج الحيواني للإرهاق المركزي لتقييم آثاره الدوائية من خلال التقييمات السلوكية.
Protocol
يلتزم هذا العمل البحثي بالمبادئ التوجيهية الأخلاقية لرعاية. تم الحفاظ على ظروف الرعاية والسكن المناسبة لضمان صحة ورفاهية ، وتمت الموافقة على جميع الإجراءات من قبل اللجنة المؤسسية لرعاية واستخدامها التابعة لجامعة بكين للطب الصيني (BUCM-4-2019041504-2094).
1. تربية وتجميعها
ملاحظة: طوال الدراسة ، تم الحفاظ على رعاية وفقا لمبادئ 3Rs (التخفيض والصقل والاستبدال).
- في هذه الدراسة ، اختر 54 فأر ويستار محدد خال من مسببات الأمراض (SPF) يبلغ من العمر ستة أسابيع ويبلغ وزن جسمه 210 جم ± 10 جرام.
- قم بإيواء الفئران في منشأة في ظل ظروف خاضعة للرقابة: درجة حرارة 23 ± 2 درجة مئوية ، رطوبة نسبية 50٪ ، ودورة ضوء / ظلام 12 ساعة / 12 ساعة. اسمح للحيوانات بالتأقلم لمدة 3 أيام قبل التجربة.
- قسم الفئران بشكل عشوائي إلى مجموعة تحكم فارغة (تسمى "أ" في الأشكال) ، ومجموعة نموذجية (تسمى "ب" في الأشكال) ، ومجموعة جرعة منخفضة من AFD (AFD-L ؛ تحمل علامة "c" في الأشكال) ، وجرعة متوسطة من AFD (AFD-M ؛ تحمل علامة "d" في الأشكال) ، ومجموعة جرعة عالية من AFD (AFD-H ؛ تحمل علامة "e" في الأشكال) ، مجموعة الإنزيم المساعد Q10 (CoQ10 ؛ المسمى باسم "f" في الأشكال) ، مع 9 فئران في كل مجموعة ، باستخدام طريقة جدول الأرقام العشوائية.
2. النمذجة والتدخل
ملاحظة: استند إنشاء هذا النموذج إلى الأدبيات السابقة13.
- استخدم صندوق النمذجة عصامي (المقدم من مختبر المناعة العصبية التابع لجامعة بكين للطب الصيني).
ملاحظة: يبلغ طول صندوق النمذجة 110 سم وعرضه 60 سم وارتفاعه 40 سم. الجزء السفلي مثبت ب 15 منصة دائرية (قطر 6.5 سم ، ارتفاع 8 سم). التباعد الأفقي بين المنصتين 13 سم ، والتباعد الرأسي 10 سم. يبلغ طول صندوق الحقل المفتوح وعرضه وارتفاعه 100 سم و 100 سم و 35 سم على التوالي. الجزء السفلي أسود ، والجدار أزرق غامق. ينقسم الجزء السفلي من صندوق الحقل المفتوح إلى 25 قسما مربعا بأبعاد 25 سم ، مع تحديد المربعات المركزية 9 على أنها المنطقة المركزية وال 16 مربعا الخارجية كمنطقة طرفية. - تأكد من أن مستوى الماء في المسبح أعلى من المنصة بحوالي 1 سم وأن درجة حرارة الماء تحافظ على 23 ± 2 درجة مئوية.
- بعد بدء التجربة ، ضع الجرذ في الصندوق المغطى بشبكة سلكية على السطح واضغط عليه بأوزان لمنع من الهروب. كمية كافية من الطعام تحت الشبكة السلكية ووفر مياه شرب نظيفة.
- ضع الجرذ في مجموعة النماذج في الصندوق في الساعة 18:00 كل يوم وأخرجه في الساعة 8:00 في اليوم التالي. بعد كل جلسة نمذجة ، جفف الجرذ وضعه مرة أخرى في قفص نظيف. قم بإجراء النمذجة بشكل مستمر لمدة 21 يوما.
- أثناء التجربة ، قم بتنظيف الصندوق وتغيير الماء يوميا وتوفير الطعام الكافي.
- فياليوم الخامس عشر من النمذجة ، قم بإدارة العوامل عن طريق غسل المعدة في الساعة 10:00 صباحا كل يوم لمدة 7 أيام متواصلة.
- يجب تطبيق مجموعة AFD-L بجرعة 3.24 غ/كغ/يوم، ومجموعة AFD-M بجرعة 6.48 غ/كغ/يوم، ومجموعة AFD-H بجرعة 12.96 غ/كغ/يوم. يتناول الإنزيم المساعد Q10 بجرعة 10 ملغم/كغ/يوم.
- عند إعطاء العوامل عن طريق غسل المعدة ، قم بإعداد تعليق عن طريق خلط الجرعة المطلوبة في الماء المقطر. حجم الإعطاء لكل مجموعة 10 مل / كغ. امنح المجموعات الفارغة والنموذجية نفس الكمية من الماء المقطر.
ملاحظة: تم حساب الجرعات التي تعطى للفئران باستخدام طريقة مساحة سطح الجسم (BSA) وتحويلها وفقا للجرعات العلاجية العادية للبشر14.
3. التقييمات السلوكية
- قوة قبضة الفئران
- أمسك ذيل الجرذ وضعه برفق على مقياس قوة القبضة.
- اسحب الجرذ للخلف بقوة موحدة مع التأكد من أن نظام الكمبيوتر يسجل البيانات بشكل صحيح.
ملاحظة: قبل التجارب ، تم تدريب الفنيين على التعامل مع الفئران لتطبيق القوة باستمرار. - كرر هذه العملية ثلاث مرات واحسب متوسط القياسات الثلاثة كقيمة قوة قبضة نهائية.
ملاحظة: لتقليل الأخطاء التي تسببها العوامل البشرية ، دع شخصا واحدا يجري التجربة بأكملها.
- اختبار المجال المفتوح في الفئران
- قم بإجراء التجارب السلوكية في بيئة هادئة ومضاءة بشكل خافت. قبل بدء كل تجربة ، ضع الفئران في غرفة السلوك لمدة ساعة واحدة من التكيف.
- تأكد من مشاركة ثلاثة مجربين في العملية وارتداء ملابس سوداء عند وضع الفئران أو توجيهها. طوال التجربة ، تأكد من أن المجربين لا يعبرون حدود الصندوق بأجسادهم أو أذرعهم.
- افتح برنامج التحليل.
- انقر فوق ملف في القائمة العلوية ، وحدد تجربة جديدة لإنشاء مشروع جديد. في إعدادات الساحة ، اختر الشكل المقابل للساحة التي سيتحرك فيها الفئران.
- باستخدام الماوس ، ارسم الساحة على الشاشة. قم بمعايرة الكاميرا وحفظ إعدادات الساحة.
- اسمح للمجرب الثاني ، الذي يرتدي ملابس سوداء ، بإمساك الجرذ من ظهره ، ووضعه بالتتابع في وسط المنطقة المحددة ، وسحب يده بسرعة.
- ابدأ تسجيلا جديدا. اضبط مدة التسجيل على 5 دقائق.
- بعد فترة المراقبة التي تبلغ 5 دقائق ، قم بإزالة الجرذ بسرعة من صندوق الحقل المفتوح وتنظيف برازه. استخدم 75٪ كحول لتنظيف صندوق الحقل المفتوح.
- كرر العملية لجميع الفئران.
- لاحظ وسجل (1) المسافة الإجمالية المقطوعة ، (2) عدد معابر المنطقة المركزية: عدد المرات التي تعبر فيها أطراف الجرذ إلى مربعات الشبكة المركزية ، و (3) الوقت الذي يقضيه الجرذ في المنطقة المركزية ، أي الوقت الذي يقضيه الجرذ في 9 مربعات للشبكة المركزية.
- متاهة المياه موريس في الفئران
- قم بإجراء التجارب السلوكية في بيئة هادئة ومضاءة بشكل خافت. قبل البدء في كل تجربة ، ضع الفئران في غرفة السلوك لمدة ساعة واحدة من التكيف.
ملاحظة: خضعت الفئران ل 4 أيام تدريب. فياليوم الخامس ، بدأت التجربة الرسمية. - تأكد من أن مستوى الماء في المسبح أعلى من المنصة بحوالي 1 سم وأن درجة حرارة الماء تحافظ على 23 ± 2 درجة مئوية.
- تأكد من مشاركة ثلاثة مجربين في العملية وارتداء ملابس سوداء عند وضع الفئران أو توجيهها.
- قسم بركة المياه إلى أربعة أرباع. إصلاح منصة في منتصف الربع الثاني. قم بإرفاق قطع مختلفة من الورق بألوان وأشكال مختلفة في وسط جدران كل ربع.
- افتح برنامج التحليل.
- انقر فوق ملف في القائمة العلوية ، وحدد تجربة جديدة لإنشاء مشروع جديد. في إعدادات الساحة ، اختر الشكل المقابل للساحة التي سيتحرك فيها الفئران.
- باستخدام الماوس ، ارسم الساحة على الشاشة. قم بمعايرة الكاميرا وحفظ إعدادات الساحة.
- خلال فترة التعلم ، دع مجربا آخر يضع الجرذ بالتتابع في مواجهة جدار المسبح في كل ربع. يختلف ترتيب التنسيب كل يوم على النحو التالي:
- في اليوم الأول ، ضع الجرذ بالترتيب التالي: الربع الأول ، الربع الثاني ، الربع الثالث ، الربع الرابع.
- في اليوم الثاني ، ضع الجرذ بالترتيب التالي: الربع الثاني ، الربع الأول ، الربع الرابع ، الربع الثالث.
- في اليوم الثالث ، ضع الجرذ بالترتيب التالي: الربع الرابع ، الربع الثالث ، الربع الثاني ، الربع الأول ؛
- في اليوم الرابع ، ضع الجرذ بالترتيب التالي: الربع الثالث ، الربع الأول ، الربع الرابع ، الربع الثاني.
- إذا فشل الجرذ في العثور على المنصة في غضون 120 ثانية ، فقم بتوجيهه إلى المنصة واسمح له بالبقاء عليه لمدة 10 ثوان.
- بعد الانتهاء من التجربة اليومية ، دع المجرب الثالث يمسح الماء من جسم الفئران باستخدام منشفة ويجففه بمجفف شعر. قم بذلك في غرفة أخرى لتجنب تداخل الضوضاء.
- في التجربة الرسمية ، قم بإزالة المنصة وضع الجرذ في الربع الثالث. سجل مسار حركة الفئران في غضون 120 ثانية.
- لاحظ وسجل (1) الوقت الذي يقضيه في الربع حيث توجد المنصة ، و (2) زمن انتقال الهروب ، وهو الوقت الذي يستغرقه الجرذ للوصول إلى المنصة من دخول بركة المياه لأول مرة.
- قم بإجراء التجارب السلوكية في بيئة هادئة ومضاءة بشكل خافت. قبل البدء في كل تجربة ، ضع الفئران في غرفة السلوك لمدة ساعة واحدة من التكيف.
4. التحليل الكيميائي الحيوي في المصل
- معالجة العينة
ملاحظة: سمح بصيام الطعام ، ولكن ليس الماء ، في اليوم السابق لأخذ العينات.- قم بتخدير الفئران باستخدام محلول خماسي باربيتال الصوديوم بنسبة 2٪ (وزن / حجم) عن طريق الحقن داخل الصفاق عند 0.5 مل / 100 جم من وزن الجسم.
- بعد التخدير الكامل ، اجمع دمائهم من الشريان الأورطي البطني باستخدام وعاء أخذ عينات الدم.
- ضع الدم كله في درجة حرارة الغرفة (RT) لمدة ساعتين ، ثم قم بالطرد المركزي عند 4 درجات مئوية ، 1522.38 × جم لمدة 20 دقيقة للحصول على المصل. Aliquote وتخزين المصل في -80 درجة مئوية لمزيد من الاستخدام.
- اختبار حمض اللاكتيك (LAC)
ملاحظة: تم تحديد تركيز LAC باستخدام طريقة قياس الألوان.- امزج محلول احتياطي الإنزيم ومحلول تخفيف الإنزيم بنسبة حجم 1: 100 لتحضير محلول عمل الإنزيم.
- قم بإعداد مطور الألوان وفقا للتعليمات الموجودة في المجموعة.
- في أنبوب فارغ ، أضف 20 ميكرولتر من الماء المقطر.
- في أنبوب قياسي ، أضف محلول قياسي 3 مليمول / لتر.
- في أنبوب القياس ، أضف 20 ميكرولتر من العينة.
- أضف 1 مل من محلول عمل الإنزيم و 0.2 مل من مطور الألوان لكل أنبوب. احتضن عند 37 درجة مئوية لمدة 10 دقائق ثم أضف 2 مل من محلول التوقف.
- انقل 200 ميكرولتر من محلول التفاعل إلى لوحة ELISA مكونة من 96 بئرا. قم بقياس قيمة OD عند 530 نانومتر. احسب تركيز LAC بناء على قيم OD.
ملاحظة: تركيز LAC = (عينة بئر قيمة OD - قيمة OD للبئر الفارغ) / (قيمة OD للبئر القياسي - قيمة OD للبئر الفارغ) × تركيز المحلول القياسي × عامل نسبة التخفيف.
- فحص الكورتيكوستيرون
ملاحظة: تستخدم مجموعات ELISA المشتراة تجاريا لقياس تركيز الكورتيزون في مصل الفئران.- قبل التجربة ، قم بتخفيف الأجسام المضادة المقترنة ببيروكسيداز الفجل الحار (HRP) ومحلول الغسيل لإنشاء حل عملي. أضف عينات قياسية بتركيزات 0 نانومول / لتر ، 5 نانومول / لتر ، 15 نانومول / لتر ، 30 نانومول / لتر ، 60 نانومول / لتر ، 120 نانومول / لتر ، و 240 نانومول / لتر إلى الصفيحة المطلية بأحجام 20 ميكرولتر.
- أضف عينات المصل (20 ميكرولتر) إلى الآبار المعنية ، متبوعة بإضافة 200 ميكرولتر من إنزيم مترافن. رج الطبق جيدا واحتضنه لمدة 60 دقيقة.
- تخلص من محلول التفاعل ، واغسل الطبق ثلاث مرات بمحلول الغسيل (400 ميكرولتر في كل مرة). بعد تجفيف اللوحة على ورق ماص ، أضف 100 ميكرولتر من كاشف لون الركيزة إلى كل بئر.
- احتضن اللوحة عند RT لمدة 15 دقيقة ، ثم أضف 50 ميكرولتر من محلول التوقف إلى كل بئر.
- قم بقياس قيم OD لكل بئر عند 450 نانومتر. استخدم قيم OD للآبار القياسية لإنشاء منحنى قياسي ثم استخدمه لحساب تركيزات عينات الآبار.
5. التحليل الإحصائي
- إجراء التحليل الإحصائي باستخدام تطبيق برمجي مناسب. تمثيل بيانات القياس كمتوسط ± انحراف معياري.
- إذا اتبعت البيانات توزيعا طبيعيا وأظهرت تجانس التباينات ، فقم بإجراء اختبار t مستقل.
- إذا اتبعت البيانات توزيعا طبيعيا ولكن لم يكن لها تكافؤ في الفروق ، فقم بإجراء اختبار t تقريبي.
- إذا لم تتبع المعطيات توزيعا طبيعيا، استخدم الاختبارات غير المعلمية للمقارنة.
- استخدم اختبار مربع كاي بيرسون لتحليل بيانات التعداد / العد.
ملاحظة: تم اختيار مستوى دلالة α = 0.05 ، حيث يشار إلى P < 0.05 على أنه معتد به إحصائيا. - قم بإنشاء الأرقام باستخدام تطبيق برمجي مناسب.
النتائج
بالمقارنة مع المجموعة الضابطة ، أظهرت الفئران في المجموعة النموذجية انخفاضا كبيرا في قوة القبضة. ومع ذلك ، فإن إعطاء AFD بجرعات منخفضة ومتوسطة وعالية كان قادرا على عكس هذا التأثير بطريقة تعتمد على الجرعة ، كما هو موضح في الشكل 1. وبالمثل ، أظهر دواء التحكم الإيجابي أيضا القدرة على عكس تغيرات قوة القبضة (الشكل 1).
في اختبار المجال المفتوح ، أظهرت فئران المجموعة النموذجية انخفاضا في المسافة الإجمالية المقطوعة ، وعدد معابر المنطقة المركزية ، ومدة وقت السكون في المنطقة الوسطى. كان إعطاء AFD بجرعات منخفضة ومتوسطة وعالية قادرا على عكس هذه التأثيرات بطريقة تعتمد على الجرعة ، كما هو موضح في الشكل 2. في الوقت نفسه ، كان دواء التحكم الإيجابي قادرا أيضا على تخفيف الأعراض (الشكل 2). يمكن ملاحظة خرائط الحرارة التي توضح ترددات المسار المتراكبة من تجارب المجال المفتوح لكل مجموعة في الشكل 3.
خلال اختبار متاهة موريس المائية ، أظهرت فئران المجموعة النموذجية زمن انتقال طويل الأمد وتقليل وقت السباحة في الربع المستهدف ، مما يشير إلى ضعف قابلية البحث المكاني. كان عقار التحكم الإيجابي ، الإنزيم المساعد Q10 ، قادرا على عكس التغييرات المذكورة أعلاه. والجدير بالذكر أن AFD عند الجرعات المنخفضة والمتوسطة والعالية عكس زمن انتقال الهروب المطول ، كما هو موضح في الشكل 4. يمكن ملاحظة الخرائط الحرارية التمثيلية لمسارات الفئران في تجربة متاهة الماء لكل مجموعة في الشكل 5.
من حيث مستويات المصل ، كان لدى الفئران في المجموعة النموذجية مستويات مرتفعة من LAC و CORT. ومع ذلك ، فإن إعطاء AFD بجرعات منخفضة ومتوسطة وعالية عكس هذه التغييرات بطريقة تعتمد على الجرعة على غرار دواء التحكم الإيجابي ، كما هو موضح في الشكل 6.
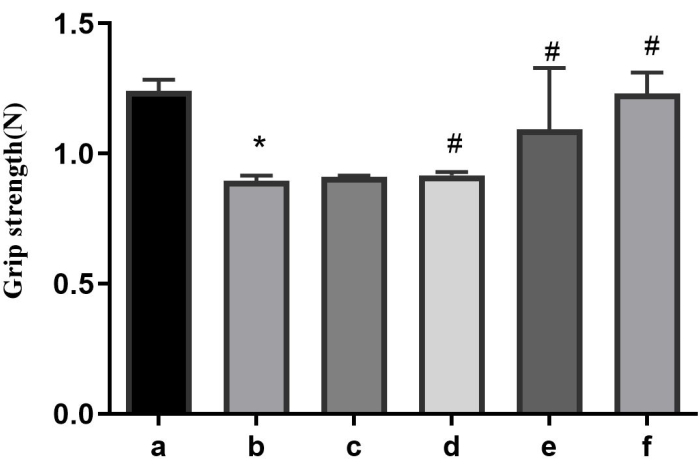
الشكل 1: نتائج قوة القبضة لكل مجموعة. أ: المجموعة الضابطة. ب: المجموعة النموذجية؛ (ج) مجموعة الوكالة الفرنسية للتنمية - اللام؛ د: مجموعة AFD-M؛ (ه) مجموعة الوكالة الفرنسية للتنمية - ح. و: مجموعة الإنزيم المساعد Q10. * ص < 0.05 مقابل المجموعة الضابطة. #p < 0.05 مقابل مجموعة الطرازات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تجربة في الميدان المفتوح وقياس مستوى النشاط الحركي. (أ) المسافة الإجمالية المقطوعة. (ب) عدد معابر المنطقة الوسطى. (ج) مدة سكن المنطقة الوسطى. ج: المجموعة الضابطة. ب: المجموعة النموذجية؛ (ج) مجموعة الوكالة الفرنسية للتنمية - اللام؛ د: مجموعة AFD-M؛ (ه) مجموعة الوكالة الفرنسية للتنمية - ح. و: مجموعة الإنزيم المساعد Q10. * ص < 0.05 مقابل المجموعة الضابطة. #p < 0.05 مقابل مجموعة الطرازات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
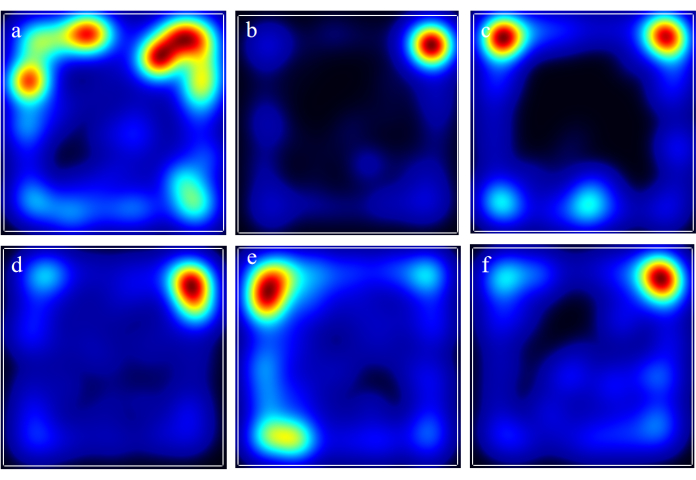
الشكل 3: خرائط الحرارة التي توضح ترددات المسار المتراكبة من تجارب المجال المفتوح لكل مجموعة. أ: المجموعة الضابطة. ب: المجموعة النموذجية؛ (ج) مجموعة الوكالة الفرنسية للتنمية - اللام؛ د: مجموعة AFD-M؛ (ه) مجموعة الوكالة الفرنسية للتنمية - ح. و: مجموعة الإنزيم المساعد Q10. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: نتائج تجربة متاهة موريس المائية في كل مجموعة. (أ) زمن انتقال الهروب. (ب) وقت السباحة في الربع المستهدف. ج: المجموعة الضابطة. ب: المجموعة النموذجية؛ (ج) مجموعة الوكالة الفرنسية للتنمية - اللام؛ د: مجموعة AFD-M؛ (ه) مجموعة الوكالة الفرنسية للتنمية - ح. و: مجموعة الإنزيم المساعد Q10. * ص < 0.05 مقابل المجموعة الضابطة. #p < 0.05 مقابل مجموعة الطرازات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: خرائط حرارية تمثيلية لمسارات الفئران في تجربة متاهة موريس المائية لكل مجموعة. أ: المجموعة الضابطة. ب: المجموعة النموذجية؛ (ج) مجموعة الوكالة الفرنسية للتنمية - اللام؛ د: مجموعة AFD-M؛ (ه) مجموعة الوكالة الفرنسية للتنمية - ح. و: مجموعة الإنزيم المساعد Q10. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: نتائج مستويات مصل LAC و CORT في كل مجموعة. (أ) مستويات مصل LAC. (ب) مستويات مصل CORT. ج: المجموعة الضابطة. ب: المجموعة النموذجية؛ (ج) مجموعة الوكالة الفرنسية للتنمية - اللام؛ د: مجموعة AFD-M؛ (ه) مجموعة الوكالة الفرنسية للتنمية - ح. و: مجموعة الإنزيم المساعد Q10. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يتكون AFD من Astragalus membranaceus (Huangqi) ، Fructus aurantii (Zhiqiao) ، Fructus crataegi (Shanzha) ، Schisandra chinensis (Wuweizi) ، Angelica sinensis (Danggui) ، و Dendrobium officinale (Shihu) ، والتي يعتقد أن لها وظيفة تنشيط الطحال وتشتيت طاقة الكبد الراكدة في الطب الصيني التقليدي. أيضا ، تعتبر كل هذه الأعشاب تمتلك ملف تعريف أمان موات وبالتالي فهي تستخدم بشكل شائع كغذاء في الصين. في الممارسة السريرية السابقة ، أظهر AFD فعالية جيدة في علاج المرضى الذين يعانون من التعب المركزي ، لكن الآلية العلاجية المحددة لا تزال بحاجة إلى مزيد من التحقيق. لذلك ، نهدف إلى التحقق من صحة آثار AFD في تحسين التعب المركزي من خلال التجارب على وتوضيح الآليات الأساسية بشكل أكبر.
يعد إنشاء نماذج حيوانية تمثل بدقة التسبب في المرض والخصائص السريرية أمرا ضروريا لإجراء البحوث الدوائية15. أنشأ فريقنا سابقا نموذجا للفئران للإرهاق المركزي من خلال الحرمان من النوم ، مما يؤدي إلى انخفاض قوة القبضة والقلق وضعف الذاكرة13. ومع ذلك، فشلنا في اكتشاف المؤشرات المصلية ذات الصلة في الدراسة السابقة. في الوقت نفسه ، تعزز ملاحظة التغيرات الكبيرة في المؤشرات الحيوية للمصل المرتبطة بالتعب صحة هذا النموذج الحيواني كتمثيل موثوق للإرهاق المركزي. في هذه الدراسة ، تم استخدام جرعات مختلفة من AFD للتدخل في نموذج الفئران للإرهاق المركزي ، مع الإنزيم المساعد Q10 (دواء معروف بتحسين التعب من خلال تعزيز استقلاب الطاقة) 16 كعنصر تحكم إيجابي. يعد التقييم السلوكي خطوة أساسية في دراسة التجارب على المرتبطة بالتعب. وبالتالي ، من الضروري للباحثين التأكد من دقة هذاالإجراء 17. عندما تم إجراء اختبار المجال المفتوح ، تم وضع في منصة مغلقة ، بهدف تقييم التغيرات في مزاجها من خلال مراقبة الأنشطة ذات الصلة18،19. متاهة موريس المائية هي نوع من التجارب التي تجبر المختبر على السباحة وتعلم كيفية العثور على منصات مخفية في الماء ، والتي تستخدم بشكل أساسي لتقييم القدرة على التعلم والذاكرة20،21. أظهرت نماذج التعب المركزي تغيرات سلوكية واضحة ، وبالتالي ، استخدمنا الاختبارين لمراقبة وتقييم التغيرات في سلوكيات الفئران. تظهر النتائج أن فئران نموذج MMPM تظهر سلوكا واضحا شبيها بالقلق وضعف القدرات على التعلم والحفظ ، وهو ما يتماشى مع نتائج البحث السابقة13.
يمكن أن يؤدي الإجهاد إلى التنشيط المفرط لمحور ما تحت المهاد والغدة النخامية والغدة الكظرية (HPA) ، مما يؤدي إلى الإفراط في إنتاج الجلوكوكورتيكويد22. يمكن أن تؤدي الارتفاعات طويلة المدى في الكورتيزول إلى إلحاق ضرر لا رجعة فيه بالخلايا العصبية ، وهو عامل مساهم مهم في تطور الأرق والاكتئاب والقلق23،24. ترتبط هذه العمليات ارتباطا وثيقا بحدوث وتطور التعب المركزي ، لذلك يعتقد أن الكورتيزول في الدم يرتبط بدرجة التعب25. أظهرت النماذج الحيوانية للتعب المركزي ارتفاعا واضحا في مستويات الكورتيكوستيرون ، والتي يمكن عكسها بشكل فعال من خلال التدخل بالأدوية ذات الصلة26. تشير نتائج هذه الدراسة إلى أن AFD يمكن أن يثبط بشكل فعال الزيادة في الكورتيكوستيرون في الدم الناجم عن التعب المركزي الناجم عن الإجهاد ، مما يظهر تأثيرا يعتمد على الجرعة. تشرح هذه النتيجة أيضا جزئيا سبب قدرة AFD على تحسين السلوك الشبيه بالقلق في نموذج التعب المركزي في الفئران.
كان اللاكتات يعتبر سابقا منتجا ثانويا لعضلات الهيكل العظمي. عندما تزداد كثافة التمرين ، تتجاوز متطلبات الطاقة القدرة الهوائية ، مما يؤدي إلى زيادة الاعتماد على التمثيل الغذائي اللاهوائي لإنتاج ATP27. تراكم حمض اللاكتيك هو المسؤول عن تحفيز المستقبلات الكيميائية في العضلات ، وينتقل هذا الإثارة إلى المخ ويصبح إشارة للألم والتعب28. تؤدي بعض العوامل المرضية أيضا إلى الإفراط في إنتاج اللاكتات ، وبالتالي تنشيط هذا القوس الانعكاسي. وصفت الأبحاث السريرية الحديثة العلاقة الوثيقة بين مستوى حمض اللاكتيك في المصل ودرجة التعب29. في ملاحظتنا السابقة ، أظهرت فئران MMPM ارتفاعا كبيرا في المصل مقارنة بالتحكم الفارغ ، مما يشير إلى وجود علاقة قوية بين زيادة مستويات اللاكتات وإرهاق العضلات أثناء الوقوف على منصة صغيرة. إن تطبيق AFD قادر على تقليل مستويات حمض اللاكتيك في المصل الذي تم جمعه من فئران WMPV إلى حد ما ، مما يحسن درجة التعب بالتتابع.
في الختام ، أظهرت هذه الدراسة أن AFD عكس بشكل فعال انخفاض قوة القبضة ، وخفف من القلق ، وحسن الذاكرة ، ربما من خلال قدرته على تقليل مستويات الكورتيكوستيرون وتحسين التمثيل الغذائي للاكتات. من المتوقع أن تقدم هذه الورقة نموذجا للدراسة التجريبية للطب الصيني التقليدي ضد التعب المركزي في الجسم الحي. يتمثل قيد الدراسة في عدم وجود خطوة متقدمة لاستكشاف أساس الآليات الجزيئية ذات الصلة. في المستقبل ، سنواصل استكشاف آثار AFD على الجهاز العصبي المركزي والتحقيق في الآليات ذات الصلة.
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح فيما يتعلق بنشر هذه الورقة. ليس لدينا علاقات مالية أو شخصية مع المنظمات أو الأفراد الذين يمكن أن يؤثروا بشكل غير لائق على أبحاثنا.
Acknowledgements
يود جميع المؤلفين الإعراب عن امتنانهم للدعم المقدم من المؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 81874428) والمشروع البحثي لجامعة بكين للطب الصيني التقليدي (رقم 2023-JYB-JBZD-001).
Materials
| Name | Company | Catalog Number | Comments |
| Corticosterone test kit | German DRG company | EIA4164 | Step 4.3 |
| Curve Expert 1.4 software | CurveExpert Professional | Version 1.4 | For calculation in corticosterone assay |
| Ethovision software | Noldus Information Technology , Netherlands | Version 15 | analysis software and video tracking system |
| Grip strength test device | Beijing Zhongshi Di Chuang limited company | ZS-ZL | Step 3.1 |
| Lactic acid test kit | Nanjing Jiancheng Bioengineering Research Institute | A019-2-1 | Step 4.2 |
| Modified multiple platform method | Neuroimmunology Laboratory of Beijing University of Chinese Medicine | None | Step 2.1 |
| Morris water maze test device | Beijing Zhongshi Di Chuang limited company | ZS-Morris | Step 3.3 |
| Open field test device | Beijing Zhongshi Di Chuang limited company | ZS-KC | Step 3.2 |
| Prism | GraphPad | Verson 8 | For generating figures |
| SPSS 26.0 | IBM | Verson 26.0 | Statistical analysis |
| Wistar rats | SiPeiFu (Beijing) Biotechnology Co., Ltd | license number: SCXK (Jing) 2019-0010 |
References
- Dukes, J. C., Chakan, M., Mills, A., Marcaurd, M. Approach to fatigue: Best practice. Med Clin North Am. 105 (1), 137-148 (2021).
- Zargari Marandi, R., Madeleine, P., Omland, &. #. 2. 1. 6. ;., Vuillerme, N., Samani, A. Eye movement characteristics reflected fatigue development in both young and elderly individuals. Sci Rep. 8 (1), 13148 (2018).
- Tornero-Aguilera, J. F., Jimenez-Morcillo, J., Rubio-Zarapuz, A., Clemente-Suárez, V. J. Central and peripheral fatigue in physical exercise explained: A narrative review. Int J Environ Res Public Health. 19 (7), 3909 (2022).
- Dotan, R., Woods, S., Contessa, P. On the reliability and validity of central fatigue determination. Eur J Appl Physiol. 121 (9), 2393-2411 (2021).
- AlSaeed, S., et al. Fatigue, depression, and anxiety among ambulating multiple sclerosis patients. Front Immunol. 13, 844461 (2022).
- Lee, C. H., Giuliani, F. The role of inflammation in depression and fatigue. Front Immunol. 10, 1696 (2019).
- Meeusen, R., Watson, P., Hasegawa, H., Roelands, B., Piacentini, M. F. Central fatigue: the serotonin hypothesis and beyond. Sports Med. 36 (10), 881-909 (2006).
- Nourbakhsh, B., et al. Safety and efficacy of amantadine, modafinil, and methylphenidate for fatigue in multiple sclerosis: a randomised, placebo-controlled, crossover, double-blind trial. Lancet Neurol. 20 (1), 38-48 (2021).
- Rojí, R., Centeno, C. The use of methylphenidate to relieve fatigue. Curr Opin Support Palliat Care. 11 (4), 299-305 (2017).
- Luo, C., et al. Natural medicines for the treatment of fatigue: Bioactive components, pharmacology, and mechanisms. Pharmacol Res. 148, 104409 (2019).
- Wang, T., Xu, C., Pan, K., Xiong, H. Acupuncture and moxibustion for chronic fatigue syndrome in traditional Chinese medicine: a systematic review and meta-analysis. BMC Complement Altern Med. 17 (1), 163 (2017).
- Xiang, Y., Lu, L., Chen, X., Wen, Z. Does Tai Chi relieve fatigue? A systematic review and meta-analysis of randomized controlled trials. PLoS One. 12 (4), e0174872 (2017).
- Zhang, W., et al. A rat model of central fatigue using a modified multiple platform method. J Vis Exp. (138), e57362 (2018).
- Drug Ther Bull. Body surface area for adjustment of drug dose. Drug Ther Bull. 48 (3), 33-36 (2010).
- Harrison, E. L., Baune, B. T. Modulation of early stress-induced neurobiological changes: a review of behavioural and pharmacological interventions in animal models. Transl Psychiatry. 4 (5), e390 (2014).
- Sanoobar, M., Dehghan, P., Khalili, M., Azimi, A., Seifar, F. Coenzyme Q10 as a treatment for fatigue and depression in multiple sclerosis patients: A double blind randomized clinical trial. Nutr Neurosci. 19 (3), 138-143 (2016).
- Grace, P. M., et al. Behavioral assessment of neuropathic pain, fatigue, and anxiety in experimental autoimmune encephalomyelitis (EAE) and attenuation by interleukin-10 gene therapy. Brain Behav Immun. 59, 49-54 (2017).
- Kraeuter, A. K., Guest, P. C., Sarnyai, Z. The open field test for measuring locomotor activity and anxiety-like behavior. Methods Mol Biol. 1916, 99-103 (2019).
- Jin, Q., et al. Network and experimental pharmacology to decode the action of wendan decoction against generalized anxiety disorder. Drug Des Devel Ther. 16, 3297-3314 (2022).
- Othman, M. Z., Hassan, Z., Che Has, A. T. Morris water maze: a versatile and pertinent tool for assessing spatial learning and memory. Exp Anim. 71 (3), 264-280 (2022).
- Bromley-Brits, K., Deng, Y., Song, W. Morris water maze test for learning and memory deficits in Alzheimer's disease model mice. J Vis Exp. (53), e2920 (2011).
- Richardson, A. E., VanderKaay Tomasulo, M. M. Stress-induced HPA activation in virtual navigation and spatial attention performance. BMC Neurosci. 23 (1), 40 (2022).
- Mikulska, J., Juszczyk, G., Gawrońska-Grzywacz, M., Herbet, M. HPA axis in the pathomechanism of depression and schizophrenia: New therapeutic strategies based on its participation. Brain Sci. 11 (10), 1298 (2021).
- Passos, G. S. Insomnia severity is associated with morning cortisol and psychological health. Sleep Sci. 16 (1), 92-96 (2023).
- Herane-Vives, A., et al. Cortisol levels in chronic fatigue syndrome and atypical depression measured using hair and saliva specimens. J Affect Disord. 267, 307-314 (2020).
- Kang, J. Y., et al. Korean red ginseng ameliorates fatigue via modulation of 5-HT and corticosterone in a sleep-deprived mouse model. Nutrients. 13 (9), 3121 (2021).
- Rabinowitz, J. D., Enerbäck, S. Lactate: the ugly duckling of energy metabolism. Nat Metab. 2 (7), 566-571 (2020).
- Proia, P., Di Liegro, C. M., Schiera, G., Fricano, A., Di Liegro, I. Lactate as a metabolite and a regulator in the central nervous system. Int J Mol Sci. 17 (9), 1450 (2016).
- Zu, Y., Lu, X., Yu, Q., Yu, L., Li, H., Wang, S. Higher postdialysis lactic acid is associated with postdialysis fatigue in maintenance of hemodialysis patients. Blood Purif. 49 (5), 535-541 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved