Method Article
الموجات فوق الصوتية داخل القصبات الشعاعية وتنظير القصبات الكهرومغناطيسي مع التنظير الفلوري لتشخيص آفات الرئة الطرفية
In This Article
Summary
يعد تشخيص أورام الرئة الصغيرة أمرا صعبا للغاية باستخدام منظار القصبات وحده. يستخدم تنظير القصبات الكهرومغناطيسي للملاحة لتحديد موقع الآفة ، على غرار نظام تحديد المواقع العالمي. تؤكد الموجات فوق الصوتية داخل القصبات الشعاعية والتنظير الفلوري الموقع الصحيح ومراقبة أخذ العينات.
Abstract
يعد تشخيص سرطان الرئة باستخدام منظار القصبات المرن إجراء آمنا مع مخاطر منخفضة جدا للمضاعفات. يتمتع تنظير القصبات بدقة تشخيصية عالية للآفات داخل القصبة الهوائية ، لكنه يقصر عند أخذ عينات من الآفات المحيطية. لذلك ، تم اختراع عدة طرق لتوجيه منظار القصبات إلى الآفة وتأكيد موقع الورم قبل أخذ عينات الأنسجة.
يستخدم التنظير الفلوري أثناء تنظير القصبات لتوفير صورة بالأشعة السينية ثنائية الأبعاد للصدر أثناء العملية. سيكون منظار القصبات والأدوات مرئيا ، وكذلك الآفات إذا كان حجمها أكبر من 2.0-2.5 سم. تتكون الموجات فوق الصوتية داخل القصبة الشعاعية (rEBUS) من مسبار بالموجات فوق الصوتية ، صغير بما يكفي لإدخاله في قناة عمل منظار القصبات. يستخدم مسبار الموجات فوق الصوتية للتمييز بين الأنسجة الموحدة ، مثل أنسجة الورم ، وحمة الرئة الطبيعية المملوءة بالهواء. ينشئ تنظير القصبات الكهرومغناطيسي للملاحة (ENB) نموذجا ثلاثي الأبعاد لشجرة الشعب الهوائية من فحوصات التصوير المقطعي المحوسب (CT) للمريض. قبل تنظير القصبات ، يتم التخطيط لمسار من القصبة الهوائية إلى الآفة ، لإنشاء توجيه في الوقت الفعلي لمنظار القصبات إلى الآفة أثناء الإجراء ، على غرار نظام تحديد المواقع العالمي. الهدف من هذه المقالة هو وصف نهج تدريجي لإجراء تنظير القصبات باستخدام rEBUS والتنظير الفلوري وتنظير القصبات باستخدام ENIB و rEBUS والتنظير الفلوري. في قسم المناقشة ، ستتم مناقشة إيجابيات وسلبيات كل طريقة.
Introduction
سرطان الرئة هو أحد أكثر أنواع السرطان شيوعا في جميع أنحاء العالم والسبب الرئيسي للوفيات المرتبطةبالسرطان 1. لذلك تم اقتراح فحص سرطان الرئة بجرعة منخفضة من التصوير المقطعي المحوسب (CT) لتشخيص المرضى قبل ظهور الأعراض2. غالبا ما يتم الكشف عن المراحل المنخفضة على أنها آفات أو عقيدات صغيرة في الرئة. من واحدة من أكبر دراسات الفحص التي أجريت في هولندا ، نعلم أن هذه الآفات غالبا ما تقع في 2/3 الخارجي من حمة الرئة وبالتالي يتم تعريفها على أنها سرطانات الرئة المحيطية3،4. لتحديد ما إذا كانت الآفة خبيثة أم لا، يلزم أخذ عينة من الأنسجة. يمكن الحصول على ذلك بعدة طرق مختلفة مثل خزعة الاستئصال الجراحي ، أو خزعة الإبرة عبر الصدر ، أو التنظير الداخلي باستخدام منظار القصبات5،6 ، حيث يكون هذا الأخير أقل عرضة لحدوث مضاعفات مقارنة بالجراحة والنهج عبر الصدر وطريقة مفضلة لتشخيص عدد متزايد من كبار السن الذين يعانون من أمراض مصاحبة كبيرة. ومع ذلك ، لا يزال عائد التشخيص أقل من الطرائق الأخرى5.
يسمح منظار القصبات بإجراء فحص بصري للقصبة الهوائية والشعب الهوائية الرئيسية ، ولكن عندما تتفرع القصبات الهوائية إلى أجزاء وأجزاء فرعية ، فإن تحديد موقع آفة صغيرة واحدة يمكن مقارنته بالعثور على إبرة في كومة قش. لذلك ، تم تطوير العديد من الطرائق الإضافية لتوجيه منظار القصبات إلى الآفة وتأكيد موقع الورم قبل أخذ عينات الأنسجة7. الغرض من هذه الطرائق هو زيادة العائد التشخيصي لأخذ عينات الأنسجة بالمنظار وتوسيع نطاق منظار القصبات نحو غشاء الجنب ، حيث يتم إجراء خزعات الإبرة عبر الصدر8،9.
يوفر التنظير الفلوري باستخدام الذراع C صورة بالأشعة السينية ثنائية الأبعاد للصدر أثناء تنظير القصبات. يمكن استخدامه لتصور موضع منظار القصبات والملقط للخزعات عبر الشعب الهوائية (TBB) لتجنب أخذ عينات من غشاء الجنب والهياكل الوعائية للوسيط 1/3 من حمة الرئة عند إجراء TBBs عشوائية. عند تشخيص سرطان الرئة ، يمكن استخدام التنظير الفلوري لتوجيه النطاق إلى موقع "تقريبي" للآفة. عادة ما تكون الآفات مرئية في التنظير الفلوري عندما يكون القطر حوالي 2-2.5 سم أو أكثرمن 10. عيب التنظير الفلوري هو خصائص الصورة ثنائية الأبعاد ، مما يجعل من المستحيل معرفة ما إذا كان النطاق في الأمام أو الخلف أو مركز الآفة11. ومع ذلك ، يتم استخدام التنظير الفلوري أيضا للتأكد من أن أدوات الخزعة في المكان المطلوب أثناء أخذ العينات إذا تم تأكيد وجود ورم بالموجات فوق الصوتية داخل القصبة الشعاعية (rEBUS) 12.
تم وصف rEBUS لأول مرة في عام 1992 بواسطة Hürter et al. ويستخدم بشكل متزايد في الفحص التشخيصي لآفات الرئة المحيطية13. تستخدم هذه الطريقة حقيقة أن أنسجة الرئة المملوءة بالهواء لا تجري موجات فوق صوتية ، في حين أن الأنسجة الأكثر كثافة ستظهر على شكل توحيد عند مسحها باستخدام مسبار الموجات فوق الصوتية. يتكون rEBUS من مسبار دائري ودوار بالموجات فوق الصوتية ، ووحدة قيادة بالموجات فوق الصوتية ، وغمد توجيه يستخدم لحماية المسبار مع ضمان الموضع الصحيح لأدوات الخزعة14. يمكن استخدام rEBUS بمفرده أو مع طرائق أخرى مثل تنظير القصبات الكهرومغناطيسي للملاحة (ENB) 15،16،17.
يستخدم ENB لتحديد موقع آفة الرئة المحيطية18. يستخدم النظام برنامجا برمجيا والتصوير المقطعي المحوسب من المريض. يتم إنشاء نموذج افتراضي للممرات الهوائية للمريض من الفحص المقطعي المحوسب ويصمم المشغل طريقا من القصبة الهوائية إلى الآفة. ثم يتم إنشاء مجال كهرومغناطيسي حول صدر المريض ويقوم البرنامج بمزامنة هذا المجال مع المجال الافتراضي الناتج عن الفحص المقطعي المحوسب، مما يساعد المشغل على اتباع المسار المخطط مسبقا أثناء تنظير القصبات، على غرار تقنية نظام تحديد المواقع العالمي. لا يوفر ENB تأكيدا في الوقت الفعلي لموقع الورم. يمكن دمج ENB مع التنظير الفلوري و rEBUS19،20. تنظير القصبات الملاحي الافتراضي (VBN) هو سلف ENB ويتكون من برنامج لإنشاء النموذج الافتراضي لشجرة الشعب الهوائية جنبا إلى جنب مع طريق إلى الآفة. لا يتضمن النظام التنقل في الوقت الفعلي ، ولكن يمكن عرض المسار أثناء تنظير القصبات21،22. تتضمن الأنظمة الجديدة VBN مع التنظير الفلوري ولكن لن يتم وصف استخدام VBN في البروتوكول23 التالي.
أنظمة ENB
حاليا ، تنتج شركتان أنظمة ل ENIB ، ونظام SPiN من Olympus ونظام superDimension و ILLUMISITE كلاهما تبيعه Medtronic. سيصف البروتوكول إجراء باستخدام نظام superDimension ، الذي يحتوي حاليا على معظم المنشورات. ومع ذلك ، فإن العديد من خطوات الإجراء قابلة للتبديل.
سيصف البروتوكول التالي كيفية إجراء rEBUS تحت التنظير الفلوري و ENB + rEBUS تحت التنظير الفلوري في بيئة سريرية. يمكن إجراء الإجراءات بسهولة تحت التخدير الواعي والتخدير العام. لن يصف البروتوكول أي طرق للتخدير. في قسم المناقشة ، سيتم عرض إيجابيات وسلبيات كل إجراء.
Protocol
يصف البروتوكول الوارد في هذه المقالة الممارسة السريرية القياسية. لم تكن هناك حاجة إلى إذن من اللجنة الأخلاقية. لا تحتوي الصور الموجودة في البروتوكول على معلومات يمكن استخدامها لتحديد هوية المرضى.
1. الموجات فوق الصوتية داخل القصبة الشعاعية
- التحضير للإجراء
- افحص التصوير المقطعي المحوسب للتحقق من علامات الشعب الهوائية وموقع الآفة قبل الإجراء.
- قم بمعايرة مسبار الموجات فوق الصوتية ، وغمد التوجيه ، وأدوات الخزعة المفضلة قبل الفحص ، مع التأكد من أن الأداة ستصل إلى نفس موضع مسبار الموجات فوق الصوتية عند إدخالها في غمد الدليل.
- قم بإجراء فحص منهجي لشجرة الشعب الهوائية والأجزاء كما هو موضح في "تنظير القصبات المنهجي: نهج 4 معالم بارزة"24.
- ضع الذراع C فوق المريض واضبطه حتى تظهر الآفة في الصورة.
- أدخل طرف منظار القصبات في الجزء أو الجزء الفرعي حيث توجد الآفة على الأرجح.
- قم بدفع غمد التوجيه والمسبار تحت توجيه التنظير الفلوري حتى يصبح طرف ورقة التوجيه المعدنية مجاورا للآفة أو فيها.
- تقدم وتفعيل المسبار. الآن ستظهر صورة الموجات فوق الصوتية على الشاشة.
- إذا كان المسبار محاطا بورم أو نسيج كثيف ، فسيظهر توحيد متحد المركز (انظر الشكل 1 أ). ابحث عن التوحيد الرمادي والمتجانس مع حدود فرط الصدى باتجاه أنسجة الرئة الطبيعية.
- إذا تم وضع المسبار بجوار الآفة ، فستكون الصورة غريبة الأطوار (انظر الشكل 1 ب).
- إذا تم وضع المسبار في أنسجة الرئة الطبيعية ، فستظهر فقط صورة متناثرة للهواء (انظر الشكل 1 ج).
- مع وجود آفات أقل كثافة مثل آفات الزجاج المطحون أو الأنسجة الالتهابية أو انخماص الرئة ، سيتم تقديم صورة أكثر تجانسا وأقل تحديدا (انظر الشكل 1 د). يحدث هذا بسبب الهواء (فرط الصدى) أو السائل (ناقص الصدى) المحاصر في الشعب الهوائية.
- إذا لم يظهر توحيد مطابق للآفة في الفحص المقطعي المحوسب، اضبط غمد التوجيه والمسبار حتى يتم تحقيق الموضع الصحيح.
- احفظ صورة التنظير الفلوري للموضع الذي يوفر فيه مسبار الموجات فوق الصوتية أفضل توحيد (سيتم استخدامه في الخطوة 1.3.2).
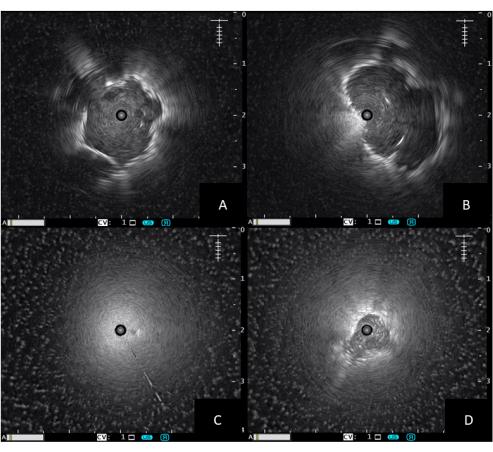
الشكل 1: صور الموجات فوق الصوتية EBUS الشعاعية. (أ) التوحيد متحد المركز ، (ب) التوحيد غريب الأطوار ، (ج) صورة الموجات فوق الصوتية المتناثرة بالهواء ، (د) التوحيد غير المنتظم. الاختصار: EBUS = الموجات فوق الصوتية داخل القصبة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- أخذ عينات الأنسجة
- قم بإزالة مسبار الموجات فوق الصوتية من غمد التوجيه وأدخل ملقطا أو أداة أخذ عينات أخرى من اختيارك.
- قارن وضع الملقط بوضع مسبار الموجات فوق الصوتية على شاشة الذراع C ، مع التأكد من إجراء أخذ العينات في الموقع الصحيح (انظر الشكل 2). تحقق من وضع الملقط ، خاصة إذا كان المريض يسعل. اجمع ما لا يقل عن 10-15 عينة باستخدام الملقط وتأكد من الموقع الصحيح عن طريق إزالة الملقط وإدخال مسبار الموجات فوق الصوتية كل أربع إلى خمس عينات.
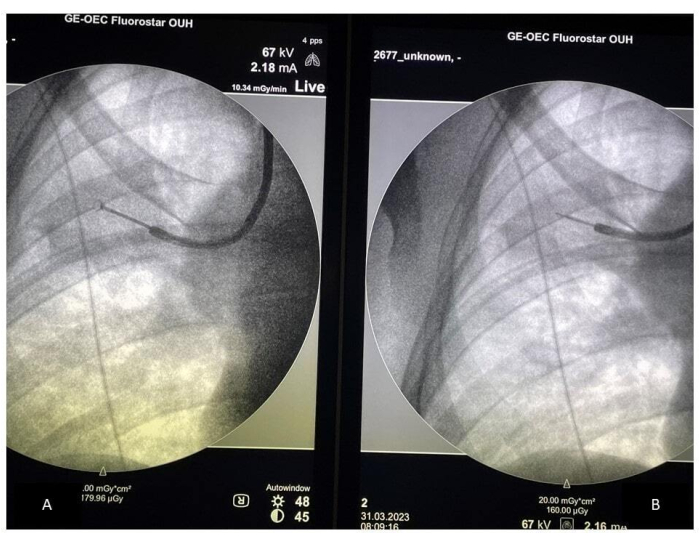
الشكل 2: أخذ العينات الموجهة بالتنظير الفلوري. (أ) وضع الملقط أثناء أخذ العينات. (ب) وضع مسبار rEBUS. اختصار: rEBUS = الموجات فوق الصوتية داخل القصبة الشعاعية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تنظير القصبات الكهرومغناطيسية للملاحة
ملاحظة: يعتمد الإجراء التالي على نظام SuperDimension من Medtronic.
- مرحلة التخطيط
- قبل الإجراء ، قم بتقييم صور التصوير المقطعي المحوسب. تأكد من أن الصورة ذات جودة عالية ، ويفضل أن تكون بشرائح لا يزيد سمكها عن 1.5 مم ، ويتم تسجيلها أثناء الإلهام لتوسيع الشعب الهوائية بالكامل مما يكشف عن الشعب الهوائية المؤدية إلى الآفة25.
- استخدم البرنامج لإنشاء نموذج ثلاثي الأبعاد لشجرة الشعب الهوائية ، حيث يتم التخطيط للطريق إلى الآفة ، بدءا من الآفة والانتقال نحو القصبة الهوائية.
ملاحظة: إذا تعذر تحديد مسار للآفة بناء على الفحوصات ، فإن ENB ليست الطريقة الصحيحة للمريض.
- تسجيل
- ضع المريض على لوح. ضع المستشعرات الثلاثة على الصدر للتعويض عن الحركات أثناء التنفس.
- ابدأ الإجراء بتنظير القصبات المنتظم24.
- أدخل قناة العمل الموسعة (EWC) والدليل القابل لتحديد الموقع في قناة العمل الخاصة بمنظار القصبات حتى يصبح طرف الدليل القابل لتحديد الموقع مرئيا.
- قفل الدليل القابل للتحديد.
- اضغط على بدء التسجيل على الجهاز أو استخدم دواسة القدم.
- أدخل منظار القصبات تدريجيا في كل قصبات فصيصية ، بدءا من الناحية المقابلة وتنتهي بالفص مع الآفة. يتم تسجيل الموضع والحركات بواسطة النظام ، ويتم استخدام المعلومات لمطابقة تسجيل الشعب الهوائية للمريض مع النموذج ثلاثي الأبعاد لشجرة الشعب الهوائية التي تم إنشاؤها بناء على الفحص المقطعي المحوسب. ابدأ التسجيل على الجانب الآخر من الآفة وانتهي من الأقرب إلى الهدف.
- عندما يظهر النظام أن جميع الفصوص مسجلة ، اضغط على مراجعة التسجيل لمعرفة ما إذا كانت نقاط التسجيل تتطابق مع النموذج ثلاثي الأبعاد الافتراضي. إذا كان هناك عدم تطابق ، كرر الخطوات 2.2.5-2.2.7 (انظر الشكل 3D).
- ملاحة
- اضغط على دواسة القدم لبدء التنقل. سيوضح البرنامج طريقا إلى الهدف. استخدم الملاحة المركزية في الممرات الهوائية الأكبر ، مع عرض صورة الفيديو من الكاميرا على طول صورة للمسار في النموذج ثلاثي الأبعاد للممرات الهوائية (انظر الشكل 3 أ).
- اتبع المسار المخطط مسبقا حتى لا يمكن تقدم النطاق بشكل أكبر.
- افتح دليل EWC وتحديد الموقع.
- قم بالتبديل من الملاحة المركزية إلى الملاحة الطرفية بالضغط على دواسة القدم.
ملاحظة: يتم إستخدام التنقل المحيطي عند تقدم EWC. خلال هذا الجزء ، يكون النموذج ثلاثي الأبعاد للممرات الهوائية مرئيا جنبا إلى جنب مع صور التصوير المقطعي المحوسب من الفحص. يتم تمييز الهدف بكرة خضراء وشبكية ، مما يوفر الاتجاه والمسافة من الهدف (انظر الشكل 3 ب). - حافظ على الهدف على الجانب الأيمن مع التأكد من إضاءة المسار ("الصحيح والمشرق"). تقدم EWC ، مما يضمن ظهور الطريق إلى الشعب الهوائية مفتوحا على صور التصوير المقطعي المحوسب.
ملاحظة: EWC قابل للمناورة ويمكن تدويره في الاتجاه المطلوب (المحاور X و Y و Z) للوصول إلى الهدف. - بمجرد أن يكون الهدف في وسط الشبكة ، بمسافة 0.4-0.9 مم من الهدف ، يكتمل التنقل.
ملاحظة: يوصى بأن لا يكون الدليل القابل لتحديد الموقع على بعد 0.0 مم من المسافة ، لأن هذا يمكن أن يتسبب في امتداد أداة الخزعة إلى ما وراء الهدف. - قم بقفل EWC في موضعه وسحب الدليل القابل لتحديد الموقع من النطاق.

الشكل 3: الملاحة الكهرومغناطيسية بالمنظار. (أ) الملاحة المركزية ، (ب) الملاحة الطرفية ، (ج) مراجعة التسجيل بمحاذاة جيدة ، (د) التصوير المقطعي المحوسب إلى تباعد الجسم. الاختصار: التصوير المقطعي المحوسب = التصوير المقطعي المحوسب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. التنظير الفلوري ، rEBUS ، وأخذ عينات الأنسجة
ملاحظة: بمجرد سحب الدليل القابل للتحديد ، يمكن استخدام التنظير الفلوري دون إزعاج المجال الكهرومغناطيسي.
- ضع الذراع C فوق المريض واضبطه حتى تظهر الآفة في الصورة.
- قم بتأكيد الموضع الصحيح ل EWC باستخدام التنظير الفلوري وعن طريق إدخال مسبار rEBUS كما هو موضح في الخطوة 1.2.5. إذا لم يكن EWC في الآفة تحت التنظير الفلوري أو لم يظهر توحيد باستخدام rEBUS ، فيجب تعديل الموضع كما هو موضح في الخطوات 1.2.4-1.2.6.
ملاحظة: يحدث التباعد من CT إلى الجسم عندما تكون المحاذاة بين النموذج ثلاثي الأبعاد الذي تم إنشاؤه ونقاط التسجيل في الوقت الفعلي منحرفة. لن يكون الهدف المحدد في موقع الآفة. - عند الوصول إلى الموقع الصحيح وتأكيده ، قم بإجراء أخذ عينات من الأنسجة كما هو موضح في الخطوات 1.3.1-1.3.2.
النتائج
تسهل التقنية الموصوفة أخذ عينات من آفات الرئة المحيطية. سيساعد EBUS الشعاعي والتنظير الفلوري أخصائي تنظير القصبات في تأكيد وجود آفة قبل أخذ عينات من الورم (انظر الشكل 1 والشكل 2). بإضافة ENIB ، يتم توجيه أخصائي تنظير القصبات إلى المكان الصحيح بدلا من البحث عن الآفة. توفر مرحلة التخطيط لأخصائي تنظير القصبات الهوائية طريقا إلى الآفة ، وتوجيها في الوقت الفعلي للآفة باستخدام نظام الملاحة ، وتأكيد وجود ورم بواسطة rEBUS ، وأخذ عينات من الأنسجة مسترشدا بالتنظير الفلوري (انظر الشكل 3). يمكن استخدام EBUS و ENB الشعاعي معا أو بشكل منفصل. غالبا ما يتم الإبلاغ عن نجاح الإجراء على أنه عائد تشخيصي = إجراءات تشخيصية مقسومة على العدد الإجمالي للإجراءات. تتراوح العائدات المبلغ عنها في الأدبيات من 47٪ إلى 83٪ لمزيج من ENB و rEBUS16،26. المضاعفات التي يتم الإبلاغ عنها غالبا هي نزيف خفيف أو استرواح الصدر ، ومع ذلك ، يتم الإبلاغ عنها عادة بنسبة أقل من 2٪ 27.
Discussion
تقدم هذه المقالة نهجا عمليا لإجراء rEBUS و ENB باستخدام التنظير الفلوري. المناقشة التالية هي رأي المؤلفين وتستند إلى خبرة سريرية عملية من مركزين.
نصائح وحيل
rEBUS
قبل الإجراءات ، يمكن استخدام تطبيق مشاية الصدر المقطعي المحوسب للتحقق من الجزء الذي توجد فيه الآفة14. ومع ذلك ، نظرا لاختلاف تشريح المرضى ، فقد تكون الآفة موجودة في جزء آخر غير معروض على التطبيق.
من الممكن استخدام مناظير القصبات الأكبر (قناة العمل 2.8 مم) أو أصغر (قناة عمل 2.0 مم) لهذا الإجراء. يسهل وضع النطاقات الأصغر في الفصوص العلوية والتقدم إلى الآفات حيث تكون القصبات الهوائية منحنية بزاوية حادة ، على سبيل المثال ، خلف القلب. توجد أغلفة وملقط أصغر للنطاقات الأصغر ، ولكن إذا تم وضع المنظار بالقرب من الآفة ، فيمكن إزالة الغمد ويمكن استخدام ملقط كبير بدلا منذلك 28. سيؤدي ذلك في بعض الأحيان إلى إنتاج عينات أفضل.
ENB
في بعض الأحيان يتوفر أكثر من طريق واحد إلى الهدف في مرحلة التخطيط. من الممكن تحميل كليهما بحيث إذا فشل أحدهما ، فمن الممكن تجربة الطرق الأخرى المخطط لها قبل إجهاض الإجراء.
يتم منحني EWC لتسهيل التنسيب في الفصوص العلوية والتحرك حول الزوايا الحادة. تأتي بزوايا مختلفة تتراوح من 0 درجة إلى 190 درجة. المجسات الأكثر انحناء مناسبة للطرق ذات الزوايا الحادة.
بعد التسجيل ، يتم عرض التداخل بين النموذج ثلاثي الأبعاد ونقطة التسجيل الفعلية في مربع تسجيل المراجعة (الشكل 3C). إذا كانت المحاذاة بين النموذج ثلاثي الأبعاد الذي تم إنشاؤه ونقاط التسجيل في الوقت الفعلي منحرفة ، فلن يكون الهدف المحدد في موقع الآفة. وهذا ما يسمى التباعد المنقط بالتصوير المقطعي المحوسب إلىالجسم 25. إذا حدث هذا ، يمكن تكرار التسجيل. خلاف ذلك ، قد لا يكون ENB إجراء مناسبا (انظر الشكل 3D).
اختيار المرضى
نظرا لأنه يمكن أخذ عينات من الآفات الطرفية عن طريق خزعة الاستئصال الجراحي ، والخزعة عبر الصدر ، والخزعة بالمنظار ، فإن أحد التحديات التي يواجهها الفيزيائي هو اختيار الإجراء المناسب لكل مريض. بالنسبة للتدريج المنصف ، تم نشر عدد كبير من الدراسات29،30. هناك مبادئ توجيهية من المجتمعات الكبيرة ، وتوجد برامج تدريبية مع تقييم الكفاءات4،31. الوضع مختلف تماما بالنسبة للآفات الطرفية.
ينص المبدأ التوجيهي الخاص بإدارة العقيدات من الجمعية البريطانية لأمراض الصدر في الواقع على أنه إذا كان خطر الإصابة بالورم الخبيث أعلى من 70٪ ، فيجب النظر في خزعة الاستئصال الجراحي أو العلاج غير الجراحي6. ومع ذلك ، لا توجد إرشادات توضح متى يجب أن يكون تنظير القصبات هو الخيار الأول ومتى يجب اختيار خزعة عبر الصدر.
أظهرت الدراسات أن حجم الآفة أقل من 2 سم ، ووضعه في الفصوص السفلية ، وعدم وجود علامة الشعب الهوائية يرتبط بانخفاض إنتاجية تشخيص تنظيرالشعب الهوائية 26،32.
في مراكزنا ، تتمثل الممارسة العامة في اختيار الإجراء الذي يحتوي على أقل خطر من حدوث مضاعفات بشرط أن يكون الحصول على التشخيص ممكنا. بالنسبة للآفات ذات التلامس الجنبي الواسع ، أظهرت الخزعات الموجهة بالموجات فوق الصوتية عبر الصدر عوائد تشخيصية عالية ومخاطر منخفضة للمضاعفات ويتم إجراؤها عندما يكون ذلك ممكنا33. خلاف ذلك ، لا يتم إجراء الخزعة عبر الصدر إلا إذا كان من غير المحتمل أن ينجح تنظير القصبات.
إيجابيات وسلبيات rEBUS و ENB
يمكن استخدام EBUS الشعاعي مع جميع المعدات الأخرى وعلى جميع المرضى القادرين على الخضوع لتنظير القصبات ، وهي ميزة كبيرة لهذه الطريقة. يمكن استخدام المسبار بنطاقات أصغر ، وهو أمر مفيد جدا عندما تكون القصبات الهوائية إلى الآفة ملتوية34. إذا كانت الآفة غير مرئية في التنظير الفلوري ، فقد يكون التنقل صعبا للغاية. يمكن أن يفسر هذا انخفاض العائد مقارنة ب ENB + rEBUS ، الذي تم نشره مؤخرا في دراسة RCT ، خاصة بالنسبة للعقيدات غير المرئية في التنظير الفلوري16.
أظهرت مراجعة منهجية كبيرة من عام 2020 إنتاجية تشخيصية مجمعة أعلى قليلا ل ENB مقارنة ب rEBUS ، وأظهرت دراستان عشوائيتان مضبوطتان عائد تشخيصي أعلى ل ENB + rEBUS مقارنة ب rEBUS وحده16،19،35. يسمح نظام الملاحة ، بالإضافة إلى تنقل EWC ، بالوصول إلى الأجزاء البعيدة من الشعب الهوائية. ستظهر مرحلة التخطيط مقاطع صعبة بشكل خاص للقصبات الهوائية لإعداد أخصائي تنظير القصبات الهوائية لهذا الإجراء.
هذه الطريقة لها أيضا بعض العيوب ، والتي يجب مراعاتها عند التخطيط لإجراء. لا يحتوي النظام على تأكيد في الوقت الفعلي لموقع الورم ، والذي يمكن استيعابه باستخدام rEBUS والتنظير الفلوري ، ولكن بشكل خاص في الفصوص السفلية بالقرب من الحجاب الحاجز ، يمكن أن يكون التصوير المقطعي المحوسب إلى تباعد الجسم محدودا لتنفيذ الإجراء36،37. تتوافق أنظمة Medtronic فقط مع منظار القصبات بقناة عمل مقاس 2.8 مم. وبالتالي ، لا يمكن استخدام نطاقات رفيعة أو رفيعة للغاية. قد يكون هذا عيبا لأن المناظير الرقيقة أسهل في المناورة من EWC. لا ينصح باستخدام ENB للمرضى الذين لديهم وحدة مزيل الرجفان أو جهاز تنظيم ضربات القلب القابلة للزرع. علاوة على ذلك ، فإن المرضى الذين يعانون من السمنة المفرطة أو تشوهات الصدر لن يتناسبوا بشكل صحيح مع اللوحة الكهرومغناطيسية مما يؤدي إلى محاذاة سيئة أو عدم المحاذاة على الإطلاق.
أخيرا ، والأهم من ذلك ، يمكن أن يكلف نظام ENB حوالي 10 أضعاف كمية المعدات الخاصة ب rEBUS. علاوة على ذلك ، فإن سعر EWC / LG للاستخدام الفردي ل ENB هو حوالي 7 أضعاف سعر أغلفة دليل الاستخدام الفردي المستخدمة في rEBUS. يمكن استخدام مجسات الموجات فوق الصوتية ل rEBUS حوالي 60 مرة قبل الحاجة إلى استبدال.
لا تسمح أي من الطرائق بأداة في الوقت الفعلي في تأكيد الآفة. ومع ذلك ، فإن النظام الأحدث من Medtronic يشتمل على صورة التركيب المقطعي الرقمي الفلوري لأخذ العينات المستمرة الموجهة بالصور38. معدلات المضاعفات منخفضة لكلتا الطريقتين35.
إذا كان هناك اختلاف كبير
توضح هذه المقالة طريقة الجمع بين الإجراءات. فقط عدد قليل من الدراسات قارنت بالفعل ENB ب ENB و rEBUS ، وبينما أظهرت دراسة RCT الوحيدة إنتاجية تشخيصية أعلى عند الجمع بين الإجراءات ، فمن غير الواضح ما إذا كان rEBUS يحسن إنتاجية ENB19،39. إذا كانت كلتا الطريقتين متاحتين ، فمن السهل جدا الجمع بينهما ولكن عند الحصول على معدات جديدة ، يجب أن يؤخذ في الاعتبار الافتقار إلى الأدلة الدامغة.
لم يتم إجراء العديد من دراسات التجارب العشوائية المضبوطة في تنظير القصبات التداخلي ، وكل من الدراسات المستقبلية والاستعادية غير متجانسة تماما ، سواء في الإعداد أو النتائج17،26،40،41،42.
تعرف الآفة المحيطية بأنها آفة تقع في الجزء الخارجي 2/3 من الصدر في إرشادات ERS حول التدريج المنصف من عام 20154. ومع ذلك ، أظهرت دراسة استقصائية من عام 2017 تنوعا كبيرا في كيفية تحديد وضع الورم بين أطباء الرئة التداخليين وجراحيالصدر 43. إذا كان هناك اختلاف كبير في اختيار المرضى للإجراءات والدراسات ، فمن الصعب جدا مقارنة النتائج. مع زيادة عدد المرضى المسنين أو الهشين ، فإن تحسين العائد بالمنظار له أهمية كبيرة. هناك حاجة إلى دراسات مستقبلية تقارن طرائق التنظير الداخلي.
rEBUS و ENB هما أداتان قيمتان لتشخيص آفات الرئة المحيطية بأمان. يمكن إجراؤها بشكل منفصل أو معا. هناك مزايا وعيوب لكلتا الطريقتين. الأدبيات المتعلقة بالتشخيص بالمنظار لآفات الرئة المحيطية غير متجانسة. على هذا النحو ، لا توجد حاليا مبادئ توجيهية لاختيار الطرائق.
Disclosures
تفضلت Medtronic بإعارة معدات ENB لمركز المحاكاة في مستشفى جامعة Odense ، لإجراء دراسة أجراها A. Juul. لم تكن Medtronic جزءا من كتابة هذا المقال
Acknowledgements
يود المؤلفون أن يشكروا جميع أخصائيي تنظير الشعب الهوائية في قسم طب الجهاز التنفسي ، مستشفى جامعة أودنسي ، على توفير صور للمقال.
Materials
| Name | Company | Catalog Number | Comments |
| Bronchoschope | Olympus | ||
| Edge Extended working channel | Medtronic | ||
| Edge locatable guide | Medtronic | ||
| Guide sheath kit | Olympus | ||
| OEC fluorostar | GE healthcare | C-arm for fluoroscopy | |
| Probe Driving Unit | Olympus | ||
| Radial EBUS probes | Olympus | ||
| superDimension | Medtronic | Navigation system |
References
- Ferlay, J., et al. Cancer statistics for the year 2020: an overview. Int J Cancer. , (2021).
- Adams, S. J., et al. Lung cancer screening. Lancet. 401 (10374), 390-408 (2022).
- Horeweg, N., et al. Characteristics of lung cancers detected by computer tomography screening in the randomized NELSON trial. Am J Respir Crit Care Med. 187 (8), 848-854 (2013).
- Vilmann, P., et al. Combined endobronchial and oesophageal endosonography for the diagnosis and staging of lung cancer. Eur Resp J. 46 (1), 40-60 (2015).
- Schreiber, G., McCrory, D. C. Performance characteristics of different modalities for diagnosis of suspected lung cancer: summary of published evidence. Chest. 123, 115-128 (2003).
- Callister, M. E. J., et al. British Thoracic Society guidelines for the investigation and management of pulmonary nodules: accredited by NICE. Thorax. 70, (2015).
- Shulman, L., Ost, D. Advances in bronchoscopic diagnosis of lung cancer. Curr Opin Pulm Med. 13 (4), 271-277 (2007).
- Eberhardt, R., Gompelmann, D., Herth, F. J. Electromagnetic navigation in lung cancer: research update. Expert Rev Respir Med. 3 (5), 469-473 (2009).
- Han, Y., et al. Diagnosis of small pulmonary lesions by transbronchial lung biopsy with radial endobronchial ultrasound and virtual bronchoscopic navigation versus CT-guided transthoracic needle biopsy: A systematic review and meta-analysis. PLoS One. 13 (1), 0191590 (2018).
- Deng, C., et al. Small lung lesions invisible under fluoroscopy are located accurately by three-dimensional localization technique on chest wall surface and performed bronchoscopy procedures to increase diagnostic yields. BMC Pulm Med. 16 (1), 166 (2016).
- Sánchez-Font, A., et al. Endobronchial ultrasound for the diagnosis of peripheral pulmonary lesions. A controlled study with fluoroscopy. Arch Bronconeumol. 50 (5), 166-171 (2014).
- Tanner, N. T., et al. Standard bronchoscopy with fluoroscopy vs thin bronchoscopy and radial endobronchial ultrasound for biopsy of pulmonary lesions: a multicenter, prospective, randomized trial. Chest. 154 (5), 1035-1043 (2018).
- Hürter, T., Hanrath, P. Endobronchial sonography: feasibility and preliminary results. Thorax. 47 (7), 565-567 (1992).
- Zhang, L., Wu, H., Wang, G. Endobronchial ultrasonography using a guide sheath technique for diagnosis of peripheral pulmonary lesions. Endosc Ultrasound. 6 (5), 292-299 (2017).
- Song, J. Y., et al. Efficacy of combining multiple electromagnetic navigation bronchoscopy modalities for diagnosing lung nodules. J Clin Med. 11 (24), 7341 (2022).
- Zheng, X., et al. A novel electromagnetic navigation bronchoscopy system for the diagnosis of peripheral pulmonary nodules: a randomized clinical trial. Ann Am Thorac Soc. 19 (10), 1730-1739 (2022).
- Sainz Zuñiga, P. V., Vakil, E., Molina, S., Bassett, R. L., Ost, D. E. Sensitivity of radial endobronchial ultrasound-guided bronchoscopy for lung cancer in patients with peripheral pulmonary lesions: an updated meta-analysis. Chest. 157 (4), 994-1011 (2020).
- Criner, G. J., et al. Interventional bronchoscopy. Am J Respir Crit Care Med. 202 (1), 29-50 (2020).
- Eberhardt, R., Anantham, D., Ernst, A., Feller-Kopman, D., Herth, F. Multimodality bronchoscopic diagnosis of peripheral lung lesions: a randomized controlled trial. Am J Respir Crit Care Med. 176 (1), 36-41 (2007).
- Folch, E. E., et al. Electromagnetic navigation bronchoscopy for peripheral pulmonary lesions: one-year results of the prospective, multicenter NAVIGATE study. J Thorac Oncol. 14 (3), 445-458 (2019).
- Asano, F., et al. A virtual bronchoscopic navigation system for pulmonary peripheral lesions. Chest. 130 (2), 559-566 (2006).
- Asano, F., et al. Virtual bronchoscopic navigation without X-ray fluoroscopy to diagnose peripheral pulmonary lesions: a randomized trial. BMC Pulm Med. 17 (1), 184 (2017).
- Tsai, Y. M., Kuo, Y. S., Lin, K. H., Chen, Y. Y., Huang, T. W. Diagnostic performance of electromagnetic navigation versus virtual navigation bronchoscopy-guided biopsy for pulmonary lesions in a single institution: potential role of artificial intelligence for navigation planning. Diagnostics (Basel). 13 (6), 1124 (2023).
- Cold, K. M., Vamadevan, A., Nielsen, A. O., Konge, L., Clementsen, P. F. Systematic bronchoscopy: the four landmarks approach). J Vis Exp. (196), (2023).
- Pritchett, M. A., Bhadra, K., Calcutt, M., Folch, E. Virtual or reality: Divergence between preprocedural computed tomography scans and lung anatomy during guided bronchoscopy. J Thorac Dis. 12 (4), 1595-1611 (2020).
- Ost, D. E., et al. Diagnostic yield and complications of bronchoscopy for peripheral lung lesions. Results of the AQuIRE Registry. Am J Resp Crit Care Med. 193 (1), 68-77 (2016).
- McGuire, A. L., Myers, R., Grant, K., Lam, S., Yee, J. The diagnostic accuracy and sensitivity for malignancy of radial-endobronchial ultrasound and electromagnetic navigation bronchoscopy for sampling of peripheral pulmonary lesions: Systematic review and meta-analysis. J Bronchology Interv Pulmonol. 27 (2), 106-121 (2020).
- Oki, M., et al. Guide sheath versus non-guide sheath method for endobronchial ultrasound-guided biopsy of peripheral pulmonary lesions: a multicentre randomised trial. Eur Respir J. 59 (5), 2101678 (2022).
- Korevaar, D. A., et al. Added value of combined endobronchial and oesophageal endosonography for mediastinal nodal staging in lung cancer: a systematic review and meta-analysis. Lancet Respir Med. 4 (12), 960-968 (2016).
- Micames, C. G., McCrory, D. C., Pavey, D. A., Jowell, P. S., Gress, F. G. Endoscopic ultrasound-guided fine-needle aspiration for non-small cell lung cancer staging: A systematic review and metaanalysis. Chest. 131 (2), 539-548 (2007).
- Farr, A., et al. Endobronchial ultrasound: launch of an ERS structured training programme. Breathe. 12 (3), 217 (2016).
- Bellinger, C., Poon, R., Dotson, T., Sharma, D. Lesion characteristics affecting yield of electromagnetic navigational bronchoscopy. Respir Med. 180, 106357 (2021).
- Laursen, C. B., et al. Ultrasound-guided lung biopsy in the hands of respiratory physicians: diagnostic yield and complications in 215 consecutive patients in 3 centers. J Bronchology Interv Pulmonol. 23 (3), 220-228 (2016).
- Oki, M., et al. Value of adding ultrathin bronchoscopy to thin bronchoscopy for peripheral pulmonary lesions: A multicentre prospective study. Respirology. 28 (2), 152-158 (2023).
- McGuire, A. L., Myers, R., Grant, K., Lam, S., Yee, J. The diagnostic accuracy and sensitivity for malignancy of radial-endobronchial ultrasound and electromagnetic navigation bronchoscopy for sampling of peripheral pulmonary lesions: Systematic review and meta-analysis. J Bronchology Interv Pulmonol. 27 (2), 106-121 (2020).
- Folch, E. E., et al. Electromagnetic navigation bronchoscopy for peripheral pulmonary lesions: one-year results of the prospective, multicenter NAVIGATE study. J Thorac Oncol. 14 (3), 445-458 (2019).
- Pritchett, M. A., Bhadra, K., Calcutt, M., Folch, E. Virtual or reality: divergence between preprocedural computed tomography scans and lung anatomy during guided bronchoscopy. J Thorac Dis. 12 (4), 1595-1611 (2020).
- Dunn, B. K., et al. Evaluation of electromagnetic navigational bronchoscopy using tomosynthesis-assisted visualization, intraprocedural positional correction and continuous guidance for evaluation of peripheral pulmonary nodules. J Bronchology Interv Pulmonol. 30 (1), 16-23 (2023).
- Juul, A. D., et al. Does the addition of radial endobronchial ultrasound improve the diagnostic yield of electromagnetic navigation bronchoscopy? A systematic review. Respiration. 101 (9), 869-877 (2022).
- Silvestri, G. A., et al. An evaluation of diagnostic yield from bronchoscopy: the impact of clinical/radiographic factors, procedure type, and degree of suspicion for cancer. Chest. 157 (6), 1656-1664 (2020).
- Silvestri, G. A., et al. A bronchial genomic classifier for the diagnostic evaluation of lung cancer. N Engl J Med. 373 (3), 243-251 (2015).
- Rozman, A., Zuccatosta, L., Gasparini, S. Dancing in the dark. Respiration. 101 (9), 814-815 (2022).
- Casal, R. F., et al. What exactly is a centrally located lung tumor? Results of an online survey. Ann Am Thorac Soc. 14 (1), 118-123 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved