알 수 없는 화합물을 결정 하는 동결 포인트 우울증
Overview
출처: 린 오코넬 연구소 — 보스턴 칼리지
고체 화합물이 용매에 용해되면 결과 용액의 동결점은 순수 용매보다 낮습니다. 이러한 현상은 동결점 우울증으로 알려져 있으며, 온도의 변화는 솔직함의 분자량과 직접적으로 관련이 있다. 이 실험은 그것의 분자량을 결정하기 위하여 동결 점 불경기의 현상을 사용하여 알려지지 않은 화합물의 정체성을 찾아낼 수 있었습니다. 화합물은 사이클로헥산에 용해될 것이며, 이 용액의 동결점뿐만 아니라 순수한 사이클로헥산이 측정될 것이다. 이 두 온도의 차이는 알 수없는 물질의 분자량의 계산을 허용합니다.
Principles
용액의 특정 특성은 솔테 분자와 용매 분자 간에 일어나는 상호 작용으로 인해 순수한 용매의 특성과 다릅니다. 이러한 변화를 나타내는 특성은 회고적 특성이라고 하며 증기 압력 강하, 비등점 고도, 동결 점 우울증 및 삼투압의 변화를 포함합니다. 이러한 특성은 입자의 ID가 아니라 용매에 용해된 입자 수에만 의존합니다. 이 경우 파티클은 이온 또는 분자로 정의됩니다. 이 실험은 동결 점 우울증의 속성에 초점을 맞추고.
특정 솔루트가 용매에 용해되면 다음 식은 true입니다.
ΔT = Tf° - Tf = Kfm
Tf°및Tf 용어는 각각 순수 용매 및 용액의 동결 점 온도를 지칭한다. 용어 "m"은 용매 의 1,000 g 당 솔직의 두더지의 수로 정의되는 용액의 당모를 나타냅니다. 이 수량은 온도 의존성이 아니기 때문에 어금니가 아닌 사용됩니다. 상수,Kf는동결점-우울증 상수라고 하며 용매에만 의존한다. 온도의 변화는 또한 용액의 솔루트 입자의 수에 따라 달라집니다 - 더 많은 입자가 존재할수록 온도의 변화가 커집니다. 이러한 이유로 이전 방정식은 다음과 같이 작성된 경우가 있습니다.
Tf° - TF = Kfim
여기서 = 용해하는 수식 단위당 생성된 단골 입자의 개수입니다. 전해질을 포함하는 용액에서 각 이온은 입자로 간주됩니다.
이 실험은 실온에서 액체인 유기 화합물인 사이클로헥산을 용매로 사용합니다. 알 수 없는 화합물은 비 이온 유기 분자; 따라서, 나는 1과 같습니다. 이 알려지지 않은 화합물의 분자량은 사이클로헥산 화합물의 용액의 동결점을 관찰하고 순수한 사이클로헥산의 동결 지점에 비교하여 결정될 수 있다.
화합물 사이클로헥산은 약 6°C의 융점(또는 동결점)을 갖는다. 얼음 욕조의 얼어 붙은 지점을 통해 실온에서 냉각으로 순수한 사이클로헥산의 일련의 온도를 얻을 수 있습니다. 이러한 온도는 시간의 함수로 플롯됩니다. 마찬가지로, 사이클로헥산에 용해된 알 수 없는 화합물의 용액의 온도는 동결지점까지 냉각될 때 얻어지며, 이는 또한 플롯된다. 플롯은 그림 1의플롯과 유사하게 보입니다. Tf°및 Tf 값은 도시된 바와 같이 추정될 수 있다. 도 1b에서용액이 동결될 때 온도가 완전히 일정하게 유지되지 않습니다. 용액의 동결점은 먼저 동결되기 시작하고 온도 시간 곡선의 경사의 변화에 의해 그래픽으로 표시되는 지점입니다.
용액의 molality, m, 솔트의 어금니 질량의 관점에서 표현 될 수있다 :


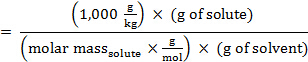
이 표현을 동결점 우울증(i = 1)에 대한 방정식으로 대체하면 다음을 얻을 수 있습니다.
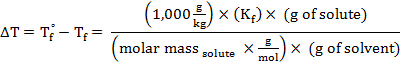
어금니 질량을 해결하기 위해 재배열, 획득 :
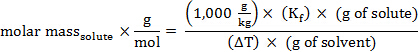
물질의 분자량(amu)은 어금니 질량과 동일한 수치 값을 가지고 있습니다.
알 수 없는 물질은 다음 화합물 중 하나입니다.:
- 비페닐 (C12H10)
- 2-브로모클로로벤젠 (C6H4BrCl)
- 나프탈렌 (C10H8)
- 안트라신 (C14H10)
- 1,4-디브로모벤젠 (C6H4Br2)

그림 1. 도 1a는 순수한 용매에 대한 Tf°의측정을 위한 시간의 함수로서 온도의 플롯이다. 도 1b는 용액에 대한 Tf의 결정에 대한 시간의 함수로서 온도의 플롯이다.
Procedure
컴퓨터에 인터페이스된 온도 프로브를 사용하여 이 실험에서 온도 판독값을 획득합니다. 온도 프로브의 불확실성은 ±0.1 °C입니다.
1. 소프트웨어의 매개 변수 설정
- 실험 의 길이를 800으로 설정합니다.
- 샘플링 속도를 초당 1 샘플로 설정합니다.
- 온도 범위에 대한 상한을 40°C로 설정하고 하한을 0°C로 설정합니다.
2. 사이클로헥산의 동결점 측정
- 디스펜싱 병에서 12.0mL의 사이클로헥산을 깨끗하고 건조한 테스트 튜브로 분배합니다.
주의: 사이클로헥산은 인화성 용매입니다. - 보풀이 없는 닦아 온도 프로브를 닦아 건조함을 확인합니다.
- 스토퍼를 온도 프로브와 와이어 교반기와 함께 테스트 튜브에 삽입합니다.
- 온도 프로브의 끝이 액체의 중앙에 있고 시험관의 측면이나 바닥을 만지지 않는지 확인하십시오.
- 600mL 비커를 물로 가득 채우고 비커가 3/4로 가득 차있을 때까지 얼음을 넣습니다.
- 데이터 수집을 시작합니다. 컴퓨터는 매 초마다 온도 판독을 얻습니다.
- 시험관을 얼음 수조로 옮기고 시험관의 액체 수준이 욕조의 수위 이하로 유지되도록 합니다.
- 즉시 와이어 교반기와 액체를 교반 하기 시작, 지속적으로 일정한 속도로.
- 동결이 시작되면 액체와 고체가 모두 존재하는 한 전체 질량이 응고될 때까지 온도가 일정하게 유지됩니다. 플롯이 일정한 온도에서 평평해지 때까지 컴퓨터가 온도를 계속 기록하도록 허용합니다.
사이클로헥산이 고체로 얼어 붙으면 온도가 다시 감소하기 시작합니다. - 충분한 수의 데이터 요소가 수집되면 데이터 수집을 중지합니다.
- 얼음 수조에서 테스트 튜브를 제거하고 실온까지 따뜻하게하십시오.
- 데이터를 저장합니다.
- 플롯이 페이지를 채우지 않도록 y축제한을 조정합니다. 그래프의 제목을 인쇄한 다음 인쇄합니다.
3. 알 수없는 화합물의 솔루션 준비
- 정확하게 계량 용지의 조각에 고체 알 수없는 물질의 0.14 g의 무게.
- 테스트 튜브에 포함된 사이클로헥산이 녹아 있는지 확인하십시오.
- 시험관에서 스토퍼를 제거하고 조심스럽게 사이클로헥산에 알 수없는 고체를 추가하여 테스트 튜브 또는 스토퍼의 측면에 준수되는 화합물의 손실을 피하십시오.
- 스토퍼를 교체하고 용지에 남아 있는 모든 결정을 고려하여 용지의 무게를 재측정합니다.
- 고체를 완전히 녹이려면 용액을 저어줍니다. 크리스탈이 남아 있지 않는 것이 중요합니다.
- 새로운 얼음 수조를 만드십시오.
4. 알 수 없는 화합물의 동결점 측정
- 컴퓨터를 준비하여 두 번째 데이터 집합을 수집합니다.
- 데이터 수집을 시작합니다.
- 용액이 들어 있는 테스트 튜브를 얼음 수조로 옮킨다.
- 즉시 지속적으로 일정한 속도로 솔루션을 교반하기 시작합니다.
- 솔루션이 정지될 때 발생하는 경사의 변화를 명확하게 보려면 300-500s의 데이터를 수집합니다.
- 데이터 수집을 중지합니다.
- 데이터를 저장하고, y축의 한계를 조정하고, 그래프의 제목을 제목으로 만들고, 인쇄합니다.
- 싱크대 아래로 사이클로헥산 또는 알 수없는 화합물을 던지지 마십시오. 액체 혼합물을 "실험실 폐기물" 항아리에 붓습니다. 테스트 튜브와 온도 프로브를 아세톤으로 헹구어 모든 결정의 마지막 흔적을 제거하고 폐기물 항아리에 헹구십시오.
Results
분배된 사이클로헥산의 질량을 계산할 수 있다. 사이클로헥산의 밀도는 0.779 g/mL입니다.

Tf°및 Tf의 값을 플롯에서 결정할 수 있습니다.
어금니 질량, 따라서 분자량, 알 수 없는 화합물의 또한 계산될 수 있다. 사이클로헥산의 경우, Kf = 20.2°C kg/몰의 솔트.
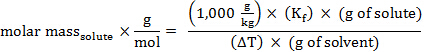

어금니 질량 = 134 g/mol
분자량 = 134 amu
가능한 화합물의 분자량은 다음과 같습니다.
- 비페닐에 대한 154.21 부뮤
- 191.46 2-브로모클로로벤젠에 대한 무
- 128.17 나프탈렌에 대한 부
- 178.23 안트라신에 대한 부뮤
- 235.90 1,4-디브로모벤젠에 대한 무명
알 수 없는 화합물의 분자량에 대해 실험적으로 결정된 값은 냅탈렌에 대한 문헌 값에 가장 가깝다.
백분율 오류를 계산할 수 있습니다.
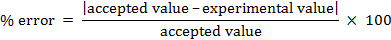
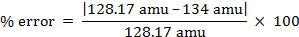
% 오차 = 4.55%
Application and Summary
아마도 동결 점 우울증의 현상의 가장 눈에 띄는 응용 프로그램은 도로와 보도가 얼음이될 때 겨울 개월 동안 발생하고, 소금은 미끄러운 표면을 치료하는 데 사용됩니다. 소금이 얼음과 섞이면 물의 동결점이 우울하여 얼음이 더 낮은 온도에서 녹습니다. 동결점 우울증의 정도는 용액의 입자 수에 의존하기 때문에 염화칼슘(CaCl2)과같은 분유 단위당 3개의 이온을 방출하는 염은 이러한 목적을 위해 종종 활용된다. 아이스크림 제조 업체는 또한 소금과 얼음이 혼합 될 때 발생하는 동결 포인트 우울증을 사용합니다. 크림의 동결 점은 0 °C 보다 훨씬 낮으며, 특히 아이스크림을 만드는 데 사용되는 설탕 및 기타 재료와 결합 될 때 특히. 이러한 이유로, 얼음과 암염은 내부 용기에 동봉된 혼합물을 동결시킬 만큼 낮은 온도를 달성하기 위해 아이스크림 제조업체의 외부 용기에 결합된다.
화학자는 고체 유기 화합물의 분석에 동결 점 우울증의 현상을 악용. 화학 합성으로부터고체 생성물의 순도는 종종 물질의 융점(이론적으로, 동결점과 동일)을 측정하여 결정된다. 화합물에 불순물이 존재하는 경우 관찰된 융점은 예상보다 낮습니다. 이는 고체가 녹기 시작하면 불순물이 화합물의 액체 형태로 용해되는 솔루트역할을 하기 때문에 발생합니다. 따라서, 화합물의 용융, 또는 동결, 소는 우울하다.
제약 산업은 치료제의 합성으로 이어지는 반응에 많은 양의 유기 용매를 사용합니다. 이 용매는 환경에 유해한 액체 폐기물의 상당한 양을 만듭니다. 때때로, 합성에서 용매에 대한 필요성을 제거하기 위해 동결 점 우울증 현상을 활용할 수 있습니다. 반응에 관여하는 고체 반응제가 함께 분쇄되면 두 화합물의 용융(또는 동결) 점이 낮아집니다. 두 화합물은 각각 매우 낮은 융점이있는 경우, 쌍은 실제로 그들이 함께 접지 할 때 실온에서 액체가되어 분자가 서로 상호 작용하여 반응이 발생할 수 있습니다. 이러한 용매없는 공정은 유해 물질의 사용 및 생성을 줄이거나 제거하는 화학 적 절차를 의미하는 "녹색"화학의 예입니다.
건너뛰기...
이 컬렉션의 비디오:

Now Playing
알 수 없는 화합물을 결정 하는 동결 포인트 우울증
General Chemistry
160.8K Views

일반적인 실험실 유리 제품 및 사용
General Chemistry
658.3K Views

솔루션 및 농도
General Chemistry
275.1K Views

고체 및 액체밀도 결정
General Chemistry
556.8K Views

수성 솔루션에서 질량 백분율 구성 결정
General Chemistry
383.8K Views

경험적 공식 결정
General Chemistry
183.7K Views

이온 화합물의 용해도 규칙 결정
General Chemistry
141.6K Views

pH 미터 사용
General Chemistry
346.7K Views

적정 소개
General Chemistry
425.4K Views

이상적인 가스 법
General Chemistry
79.0K Views

평형 상수의 분광측정 결정
General Chemistry
158.7K Views

르 샤텔리에의 원리
General Chemistry
265.8K Views

금리법 및 대응 순서 결정
General Chemistry
196.3K Views

차동 스캐닝 열량측정을 사용하여 엔탈피의 변화를 측정합니다.
General Chemistry
44.7K Views

조정 화학 단지
General Chemistry
91.7K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유