Reactor de fase líquida: Inversión de sacarosa
Visión general
Fuente: Kerry M. Dooley y Michael g. Benton, Departamento de ingeniería química, Universidad Estatal de Louisiana, Baton Rouge, LA
Reactores de flujo continuo y por lotes son utilizados en reacciones catalíticas. Camas embaladas, que utilizan catalizadores sólidos y un flujo continuo, son la configuración más común. En la ausencia de una corriente de reciclaje extenso, tales reactores de lecho empacado se modelan generalmente como "plug flow". El otro reactor continuo más común es un tanque agitado, que se supone que se mezcla perfectamente. 1 una de las razones para la prevalencia de reactores de lecho empacado es que, a diferencia de la mayoría de los diseños de tanque agitado, un área de pared grande al cociente del volumen del reactor promueve la transferencia de calor más rápida. Para casi todos los reactores, calor debe añadido o retirado para controlar la temperatura para la reacción deseada.
La cinética de reacciones catalíticas son a menudo más complejos que la simple orden de 1st , 2nd orden, cinética etc. encontrado en los libros de texto. Las tarifas de la reacción también pueden verse afectadas por tarifas de transferencia de masa - reacción no puede ocurrir más rápidamente que la tasa en que reactivos se suministran a la superficie o la tasa a la que se eliminan los productos - y la transferencia de calor. Por estas razones, la experimentación es casi siempre necesaria para determinar la cinética de reacción antes de diseño de equipos a gran escala. En este experimento, exploramos cómo llevar a cabo tales experimentos y cómo interpretar mediante la búsqueda de una expresión de la velocidad de reacción y una constante de velocidad aparente.
Este experimento explora el uso de un reactor de lecho empacado para determinar la cinética de la inversión de la sacarosa. Esta reacción es típica de aquellos caracterizados por un catalizador sólido con productos y reactantes de la fase líquida.
sacarosa → glucosa (dextrosa) + fructose(1)
Un reactor de lecho empacado será operado en diferentes caudales para controlar el espacio tiempo, que se relaciona con tiempo de residencia y es análogo al tiempo transcurrido en un reactor discontinuo. El catalizador, un ácido sólido, primero va ser preparado mediante el intercambio de protones para otros cationes presentes. Entonces, el reactor se calentará a la temperatura deseada (operación isotérmica) con el flujo de reactivos. Cuando se ha equilibrado la temperatura, muestreo de producto comenzará. Las muestras se analizarán por un polarímetro, que mide la rotación óptica. Rotación óptica de la mezcla puede estar relacionada con la conversión de sacarosa, que se puede utilizar entonces en el análisis de la cinética de la estándar para determinar el orden de la reacción, con respecto a la sacarosa reactivo y la constante de velocidad aparente. También analizarán los efectos de la mecánica de fluidos - no axial mezcla (flujo tapón) vs algunos mezcla axial (tanques agitados en serie) - en la cinética.
Principios
En comparación con reactores continuos de tanque agitado (CSTRs), reactores de flujo de tapón (PFRs) son generalmente mejor adecuados para reacciones rápidas y efectos de calor grande. 2 sin embargo, la caída de presión y el desarrollo de "puntos calientes" pueden ser problemáticos. Por lo tanto, tamaños de partícula del catalizador no pueden ser demasiado pequeños y deben seguirse procedimientos de arranque cuidadoso.
Un PFR es matemáticamente equivalente a un gran número de pequeños, tamaño CSTRs en serie cuyo peso total volumen o catalizador coincida con el del sistema. Cuando la mezcla se produce en la dirección axial, disminuye el número de tanques, N, necesario para describir la operación del reactor. El modelo se llama el modelo de "Tanques en serie". Los parámetros N y τ (tiempo espacio) del modelo pueden a veces obtenerse la media y varianza de la residencia tiempo distribución (E-curva) del reactor. Un PFR, exactamente se puede calcular la media y la varianza es cero. Para un reactor real, τ es generalmente estimado, y N se regresa desde el modelo (ecuación 2):
 (2)
(2)
donde "" es el número de reactores, CAo es la concentración de alimentación del reactivo limitante (en este caso, sacarosa), ΔfAi es el cambio en la conversión fraccional de "A" en el el tanque agitado y rAi es la tasa de evaluadas en las concentraciones de salida del tanque de reacción. Esta tasa debe ser positivo. Resolver el balance de masa para igual tamaño CSTRs en serie también se pueden utilizar para determinar el orden de reacción para "A" utilizando los datos de un reactor real y suponiendo que la temperatura se pueden mantener razonablemente constantes y eso N es conocido.
La ecuación de la tasa forward para una reacción catalítica es casi siempre 1 orden dest en la concentración de catalizador y algunos ≤2 de orden positivo en la concentración de cualquier reactivo. Productos a veces pueden inhibir el catalizador, causando el fin del reactivo aparece menos de lo que realmente es. Incluso reactivos pueden inhibir el catalizador, dando por resultado órdenes para un reactivo más cercano a cero. Por estas razones, reacciones catalíticas son expresadas a menudo por un modelo de "ley de potencia":2
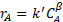 (3)
(3)
donde 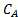 es la concentración de reactivo, de limitar k' es la constante de velocidad aparente, y
es la concentración de reactivo, de limitar k' es la constante de velocidad aparente, y  es el orden de reacción aparente. Este modelo presupone que la concentración de catalizador es constante (se absorbe en la constante de velocidad verdadera de dar k'). En la vida real, catalizadores a menudo desactivar, es decir, Cgato [en sitios ácidos mmol/gcat] disminuye debido a la acumulación de venenos del catalizador. Por esta razón uno debe ya sea cuenta de desactivación (express Cgato en función del tiempo onstream) o (preferiblemente) recopilar datos durante un período de tiempo donde el catalizador es relativamente estable.
es el orden de reacción aparente. Este modelo presupone que la concentración de catalizador es constante (se absorbe en la constante de velocidad verdadera de dar k'). En la vida real, catalizadores a menudo desactivar, es decir, Cgato [en sitios ácidos mmol/gcat] disminuye debido a la acumulación de venenos del catalizador. Por esta razón uno debe ya sea cuenta de desactivación (express Cgato en función del tiempo onstream) o (preferiblemente) recopilar datos durante un período de tiempo donde el catalizador es relativamente estable.
La cinética de la inversión de la sacarosa se encuentran para ser de primer orden en la concentración de sacarosa y primer orden en la concentración de sitios de catalizador. Lifshutz y Dranoff informan una constante de velocidad de segundo orden k de ~0.029 mL / (mmol de ácido centros • min) para un catalizador similar a la utilizada aquí a 60 ° C con una energía de activación de 77 kJ/bandeo4 Gilliland et al informe ~1.21 mL / (mmol de ácido centros • min) con una energía de activación de 84 kJ/mol para un catalizador similar en estas condiciones. 4 las diferencias significativas en k pueden presentarse de varios factores: (a) efectos de calor y transferencia de masa en la cinética; (b) distribución del flujo mala; (c) control de temperatura pobre; y (d) los Estados de activación del catalizador.
El espacio tiempo (análogo al tiempo de residencia) para un reactor catalítico se expresa generalmente como 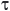 = W/Q, donde W es el peso de catalizador y Q es el caudal volumétrico de la alimentación. Las unidades de la constante de velocidad se ajustan a cuenta para las unidades en el espacio tiempo (es decir, para un 1st orden reacción de las unidades de k' sería igual a 1 /
= W/Q, donde W es el peso de catalizador y Q es el caudal volumétrico de la alimentación. Las unidades de la constante de velocidad se ajustan a cuenta para las unidades en el espacio tiempo (es decir, para un 1st orden reacción de las unidades de k' sería igual a 1 /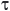 ). La figura 1 ilustra el comportamiento de las reacciones de varias órdenes de cinética en ambos un PFR y en un modelo de tanques en serie que consta de dos tanques. Tenga en cuenta que para las órdenes positivas, el PFR es siempre superior.
). La figura 1 ilustra el comportamiento de las reacciones de varias órdenes de cinética en ambos un PFR y en un modelo de tanques en serie que consta de dos tanques. Tenga en cuenta que para las órdenes positivas, el PFR es siempre superior.

Figura 1. Calcula conversiones fraccionarias (vs tiempo, espacio) de sacarosa utilizando tasa constantes derivadas de los datos de varias fuentes de sacarosa a 60 ° C.
Para determinar la cantidad de azúcar, se utiliza un polarímetro, que mide el grado de rotación de la luz polarizada por el compuesto analizado. Azúcares son ejemplos de compuestos con los enantiómeros que se pueden diferenciar por su actividad óptica, la capacidad de rotar luz. Un polarímetro es especialmente adecuado para la medición de las concentraciones en este experimento porque la sacarosa reactivo gira la luz hacia la derecha (rotación óptica positiva), mientras que los productos glucosa y fructosa giran a la izquierda (rotación óptica negativa).
Procedimiento
Propiedades del catalizador son: tamaño = 20-40 malla; peso = 223 g; contenido de agua = 30 wt. %; densidad aparente (aparente) = 1,01 g/mL; concentración de ácido sitio = 4,6 mmol sitios de ácido/g peso seco; área de superficie = 50 m2/g; macroporosidad (macropore volumen total volumen cat.) = 0,34; macropore tamaño promedio = 80 nm. En la figura 2muestra un diagrama P & ID de la unidad. Para este experimento, se utilizan sólo cama #1, el depósito de materia orgánica, bomba y rotámetro. Las muestras se recogen en el drenaje superior. T505 es el regulador de temperatura.
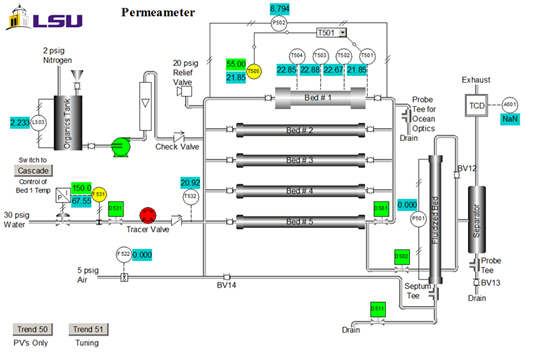
Figura 2 . Representación de P & ID del aparato (interfaz de sistema de control).
1. puesta en marcha del Reactor
- Acceder a la interfaz de sistema de control distribuido. Desde el punto de unidad en el menú, seleccione Perm. Aparece la Perm P & ID esquemático (figura 2). Todos los datos se pueden recoger en una hoja de cálculo de Excel. Haga clic en "Tendencia 50" en la interfaz para obtener las variables de proceso clave con respecto al tiempo.
- Abra las válvulas de entrada y salida para el lecho del reactor catalítico (cama #1). Asegúrese que estén cerradas las válvulas de entrada y salida a las camas de otros, y que la válvula de control (F531) y válvula de cierre (D531) en el suministro de agua de la ciudad también están cerradas.
- Añadir ácido diluido (0,25 M H2SO4) al tanque de alimentación (2 L).
- Encienda la bomba de alimentación a una velocidad constante (por lo menos 3 en el dial) y establezca el rotámetro para dar la velocidad de flujo deseada (40-70 mL/min). Si el rotámetro no puede controlar el flujo en esta gama, aumentar la velocidad de la bomba a la posición más alta siguiente.
- Una vez que ha sido alimentado con ácido, agregue 200 mL o más de agua desionizada al tanque de alimentación. El ácido se intercambian de protones para cualquier otros iones (Na+, Ca2 +) se unen a los aniones del ácido sulfónico. Esto es porque incluso DI el agua contiene impurezas y agua municipal contiene aún más. Esto se llama "regeneración" del catalizador.
- Preparar al menos 10 L de solución de alimentación con 15 wt % de sacarosa en agua desionizada. Al preparar la solución de sacarosa, añada lentamente la sacarosa en el agua removiendo a temperatura ambiente. Usar un agitador magnético y un remo.
- Añadir la alimentación en el depósito de materia orgánica.
2. operación de Reactor de lecho empacado
- Para comenzar el flujo de alimentación de sacarosa, encienda la bomba y ajustar el flujo deseado usando el regulador de la velocidad de la bomba y el rotámetro. El variador es para ajuste bruto, mientras que el rotámetro es para el ajuste fino.
- Programa el punto de referencia para T505 a 50° C y establecerlo en automático. El sistema está programado para cortar los calentadores si la temperatura alcanza los 90° C, o si la caída de presión, medida por el transmisor de presión diferencial, cae por debajo de 1 pulgada en la presión de columna de H2O, que indica que no hay ningún alimento.
- Una temperatura típica para la reacción es de 60° C. Cuando la temperatura del reactor primero excede 50° C, mueva que el punto a esto la temperatura final deseada. Un perfil de temperatura se puede observar a través de la sección de catalizador, que puede visualizarse mediante el examen de termopares T502 y T503.
- Recoger muestras de 25 mL de los productos de reacción en el drenaje superior en tubos de ensayo o frascos para muestras 10 minutos aparte. No recoja muestras hasta que han pasado por tiempos de residencia de por lo menos dos camas (el volumen abierto de la cama es ~1.2 L).
3. Apagar el sistema
- Sistema de la T-505, cama #1 control de la temperatura a cero salida de MANUAL.
- Cerrar el flujo en el reactor una vez que la temperatura comienza a disminuir.
- Cierre las válvulas de bloque en la cama #1.
4. usando el polarímetro
Analizar muestras de productos de la reacción y la inicial de la alimentación con el polarímetro. Para un 15 WT % de sacarosa de la alimentación, conversiones deben estar en el rango de 80 a 120 mL/min pura sacarosa, glucosa y fructosa se deben utilizar como los estándares de calibración. Consulte el apéndice para más detalles en polarimetría.
- Encienda la lámpara de sodio y deje que se caliente durante aproximadamente 5 a 10 min. Una luz amarilla será visible.
- Verifique la posición cero del dial. A cero, un campo oscuro uniforme sin franjas de oscuridad/luz, deben ser observados.
- Añadir 25 mL de la solución inicial de alimentación a un tubo limpio. Asegúrese de que el tubo esté lleno. Utilizar el mismo tubo para calibraciones y mediciones porque la lectura es dependiente de la longitud de ruta.
- Coloque el tubo en el polarímetro. El tubo debe estar hacia arriba para quitar cualquier aire de la línea de la vista y el foco debe estar cerca del ocular.
- Cierre la tapa. Si la solución gira la luz polarizada, se deben observar franjas de luz/oscuridad a través de la lente.
- Gire el dial hasta que desaparezcan las franjas y se observa un campo oscuro uniforme.
- Leer el ángulo de rotación a través de la lupa utilizando el nonio. Las divisiones de la esfera son 1 grado y cada división vernier 0.05°. Para ajustar el enfoque, gire el dial negro situado debajo del ocular.
- Repetir para cada muestra. Utilizar agua desionizada para limpiar el tubo antes de cada medición.
Resultados
El polarímetro determina las conversiones fraccionarias de sacarosa después de la reacción en un reactor de lecho empacado. Una previa calibración del polarímetro para un tres fuentes diferentes de la sacarosa se muestra en la figura 3.

Figura 3 . Relación entre el grado de rotación y la conversión fraccional de sacarosa de diferentes concentraciones de alimentación.
En la figura 4 se presentan datos de muestra para la reacción a 60 º C en sacarosa diferente concentraciones de alimentación. Las conversiones fraccionarias se calcularon directamente de la curva de calibración del polarímetro mediante la siguiente ecuación, donde D corresponde a los grados de rotación desde el polarímetro:
 (4)
(4)

Figura 4 . Reacción de inversión de la sacarosa a 60 º C, 100 mL/min velocidad de alimentación.
Para 0th y reacciones de orden 1st , la conversión en un PFR es independiente de la concentración de alimentación. 2 además, k' deben ser invariantes para cinética de orden 1st . Suponiendo que el reactor ser un PFR, la constante de velocidad de orden 2nd , k2 (mmol/mL sitios • min), fue determinada por contabilidad para la 1st orden dependencia el catalizador y la constante de velocidad de orden pseudo-1st k' () mL/gcat • min) se determinó haciendo caso omiso de la dependencia de ordenst 1 del catalizador. Los resultados de la pseudo -k' cálculos se representan gráficamente en la figura 4. Y el valor de k2 se encontró dividiendo k' por la concentración de catalizador (mmol sitios de ácido/gcat) dado previamente.
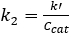 (5)
(5)
Para determinar si la cinética de la reacción fueron más cerca de 0, 0.5, 1, 1.5 o 2nd orden en sacarosa, regresión no lineal de balance de masa se utiliza, y se reduce al mínimo la suma de errores cuadrados para todas las ejecuciones de tres. Para utilizar la regresión no lineal, se formuló una función objetivo basado en el balance de masas integrado de PFR y el orden de la reacción respectiva. Por ejemplo, la siguiente es la función objetivo para un 1.5 orden cinético en la concentración de sacarosa:
 (6)
(6)
Pueden formularse otras funciones objetivo de las soluciones estándar de balance de masa del PFR, que pueden encontrarse en todos los libros de texto cinética. 2 Los datos experimentales en la figura 4 se ajuste a los saldos totales integrados de PFR 1, 1,5 y 2 órdenes con respecto a la sacarosa. La suma de errores cuadrados para las órdenes de tres reacción estaban decididos a ser 0.39, 0.16 y 1.3, respectivamente. Por lo tanto, el mejor ajuste fue encontrado para ser n = orden de 1,5. Esto conduce a un k' valor de 35 (mL/gcat • min).
Inicialmente se pensó que la cinética era 1 orden dest con respecto a la sacarosa. 2-3 con este supuesto, uno puede determinar el número de volumen igual CSTRs, N, en la serie que se requiere para modelar este reactor. Otra vez, la suma de cuadrados de errores en el balance de masa para todos tres carreras se redujeron para determinar ambos N y k'. Los datos se ajustaron al modelo de tanques en serie para reacciones de orden 1st :
 (7)
(7)
Se encontró que N = 2,1 "tanques" y k' = 0,62 mL/gcat • min. Esto no es un gran ajuste porque el orden de reacción no es exactamente 1. Los datos sugieren un orden de sacarosa > 1. Las desviaciones estándar relativas de fA fueron a lo más 2%, lo que fácilmente se explica por la variación de temperatura (tan alto como 9 ° C). No había evidencia de desactivación del catalizador. Las conversiones fraccionarias para ambos un PFR y dos tanques CSTR en serie se calculó usando la k de regresión no lineal y grafica en la figura 1. Para la orden del zeroth, no hubo diferencias entre un PFR y CSTRs en serie porque la velocidad es independiente de la concentración de sacarosa. Si habían sido trazadas las curvas para CSTRs 6 o mayores, habría coincide estrechamente con las curvas PFR. Las conversiones fraccionarias previstas de dos tanques CSTR en serie es más lento que un PFR para todas las órdenes de reacción. Los datos experimentales de 15 wt % de sacarosa están realmente más cercanos a una reacción de primer orden en PFR.
El error en k' puede estimarse mediante la comparación de las diferencias en k computada ' valores de la desviación de temperatura media (4,5 ° C) a la temperatura de la reacción, 60 ° C, utilizando la ecuación de Arrhenius y el promedio de las energías de activación de dos literatura. El k Estimado ' para 1.5 orden cinética a 64,5 ° C es 52 (mL/mol)0.5 mL • gcat-1 • min-1, que es casi el 50% más alto que el valor regresado de 35 (mL/mol)0.5 mL • gcat-1 • min-1. Pequeñas variaciones de temperatura pueden afectar el k' mucho.
Aplicación y resumen
La reacción no se comportan exactamente como se esperaba porque el aparente orden n es > 1. De todos los fenómenos que pueden causar tales desviaciones en los reactores reales, desviaciones del comportamiento ideal de PFR por mezcla axial son sugeridas por el hecho de que ajuste para el modelo de tanques en serie da sólo un pequeño número de tanques - para un perfecto PFR, N debe ser al menos 6 . Tales desviaciones se encuentran en las camas relativamente corto, especialmente si el flujo es multifase (el agua se vaporiza en el reactor). Sin embargo, otra de las causas de la desviación es menos aparente pero probablemente aún más importante. La reacción es altamente exotérmica, y como se ha mencionado, la temperatura osciló hasta 9° c (sobre todo sobre el punto de ajuste). La sacarosa más en la alimentación, más calor que se genera. Como podría esperarse, las oscilaciones fueron más significativas con el 20% de peso de la alimentación. Esto sugiere otra razón para un aparente orden n > 1: más calor generado en una mayor concentración de la alimentación aumenta la temperatura del reactor más, que a su vez aumenta la velocidad de la reacción dando por resultado un orden aparente derivada > la orden real. Si la temperatura es controlada, puede aumentar la temperatura del reactor hasta el límite adiabático. Desviaciones del comportamiento ideal de PFR en flujo y la temperatura pueden afectar la cinética aparente derivada de los reactores reales, poner una prima en reactor cuidadoso escalado para duplicar las condiciones de la planta piloto de flujo de fluidos y transferencia de calor.
Reactores de lecho empacado tienen muchos usos en la industria química. Ácido sulfúrico, un químico usado para hacer cientos de productos diferentes, comúnmente se fabrica en parte utilizando reactores químicos de lecho empacado en serie. Más de 200 millones de toneladas se producen anualmente. En esta reacción, dióxido de azufre y el aire pasan a través de reactores de lecho fijo en serie (con intercambiadores de calor intermedios para eliminación de calor) que contiene un catalizador de óxido de vanadio soportado en las temperaturas altas. 4 el SO2 se oxida a SO3, que, cuando se absorbe en agua, hace que el ácido sulfúrico.
Un uso más reciente de reactores de lecho empacado es en la producción de biodiesel por transesterifying triglicéridos o ácidos grasos esterificante, con metanol. Mientras que el biodiesel se produce de diferentes maneras, reactores de lecho empacado pueden ser ventajosos para la producción continua. Biodiesel se considera una fuente de energía renovable ya que se produce a partir de algas o desechos alimenticios, y porque es biodegradable y no tóxico. Independientemente el catalizador utilizado, debe ser completamente purgó del producto después de la reacción, porque incluso pequeñas cantidades pueden inutilizar el combustible. 5
APÉNDICE A – USANDO EL POLARÍMETRO
Polarimetría mide el grado en que una sustancia interactúa con luz plana polarizada (luz que consiste en ondas que vibran en un plano). Puede girar la luz polarizada a la izquierda, a la derecha, o no. Si se gira la luz polarizada hacia la izquierda o hacia la derecha, es "ópticamente activa". Si un compuesto no tiene un centro quiral, no girará luz polarizada. El número de grados y la dirección de rotación se mide para dar la rotación observada. Se corrige la rotación observada para la longitud de la celda utilizada y la concentración de la solución, utilizando la siguiente ecuación: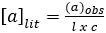 (A1)
(A1)
donde: a = rotación específica (grados) (valor de la literatura), l = longitud del camino (dm) y c = concentración (g/mL).
Comparando la corrección observada rotación a los valores de la literatura puede ayudar en la identificación de un compuesto desconocido. Sin embargo, si se conocen los compuestos, es más común preparar estándares de calibración de las incógnitas y correlacionar la rotación observada a la concentración.
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Reactor de fase líquida: Inversión de sacarosa
Chemical Engineering
9.7K Vistas

Prueba de la eficiencia de transferencia de calor de un intercambiador de calor de tubos con aletas
Chemical Engineering
18.0K Vistas

Uso de una bandeja de secado para investigar la transferencia de calor convectiva y conductiva
Chemical Engineering
44.0K Vistas

Viscosidad de las soluciones de propilenglicol
Chemical Engineering
33.2K Vistas

Porosimetría de un polvo de alúmina de sílice
Chemical Engineering
9.7K Vistas

Demostración del modelo de ley de energía a través de extrusión
Chemical Engineering
10.3K Vistas

Amortiguador de gas
Chemical Engineering
36.9K Vistas

Equilibrio vapor-líquido
Chemical Engineering
89.6K Vistas

El efecto de la relación de reflujo en la eficiencia de destilación de bandeja
Chemical Engineering
77.9K Vistas

Eficiencia de la extracción líquido-líquido
Chemical Engineering
48.6K Vistas

Cristalización del ácido salicílico mediante modificación química
Chemical Engineering
24.3K Vistas

Flujo monofásico y bifásico en un reactor de lecho compacto
Chemical Engineering
19.0K Vistas

Cinética de la polimerización por adición de polidimetilsiloxano
Chemical Engineering
16.4K Vistas

Reactor catalítico: Hidrogenación de etileno
Chemical Engineering
30.5K Vistas

Spin y Chill
Chemical Engineering
7.4K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados